TSMP :

1
TS Cours Physique
Chap 11 La spectroscopie et le modèle corpusculaire de la
lumière
INTRODUCTION : Le modèle ondulatoire de la lumière permet d’interpréter les phénomènes de diffraction et d’interférences
lumineuses mais ne permet pas de comprendre l’origine de la couleur naturelle des objets (Soleil = « jaune », herbe verte, fleurs de
différentes couleurs…). Pour cela, il faut choisir un autre modèle imaginé par Einstein en 1905, un modèle où on considère la lumière
comme constituée de « grains de lumière » baptisés « photons ».
I. LE PHOTON : « CORPUSCULE » de LUMIERE
1. L’effet photoélectrique :
a) Expérience de Hertz (1888)
Observations :
(1) l’électroscope chargé négativement se
……………………….. progressivement
(2) En introduisant une plaque de verre, absorbant les UV
mais transparente aux radiations visibles, l’électroscope reste
……………….., même après une illumination prolongée.
b) Analyse de l’expérience
(1) Les e- en excès sur la lame de Zn sont ………………………….. au métal : c’est l’effet …………………..…………………
(2) cet effet ne se produit pas pour des rayonnements peu énergétiques comme la lumière visible (grandes ) mais qu’avec les UV
(plus petites)
(3) Une illumination prolongée de lumière visible ne permet pas d’« accumuler de l’énergie » pour extraire les e- (contrairement à une
succession de vagues qui pourraient finir par « casser une digue »).
Conclusion : le modèle ondulatoire de la lumière n’interprète pas ces faits expérimentaux.
c) Les idées d’Einstein
* Les échanges d’énergie entre la matière (lame Zn) et le rayonnement (UV ou visible) sont discontinus et s’effectuent par « paquets
d’énergie » appelés ……………………….. d’énergie.
* La lumière peut être assimilée à un « jet de particules » appelées …………………………… qui se propagent dans le vide à la
vitesse limite c = 3,00*108 m*s-1 et qui transportent chacun un quantum d’énergie.
Ainsi, si l’énergie du photon incident est supérieure à l’énergie d’extraction de l’e- du cristal métallique, celui-ci est arraché (cas des
UV), sinon non (cas du visible).
Conclusion : un tel modèle corpusculaire de la lumière permet d’interpréter l’effet photoélectrique.
2. Carte d’identité du photon
* Une radiation EM peut être assimilée à un « jet de corpuscules » : les ……………………………….
* un photon est une particule de charge électrique ……………………….., de masse ………………., se déplaçant à la vitesse limite
c = 3,00*108 m*s-1 et transportant un quantum d’énergie d’intensité proportionnelle à la fréquence
de la radiation lumineuse :
E = …………………..
avec h = constante de Planck = 6,62*10-34 J*s
Lame
Zn
-
-
-
Cas (1)
-
-
-
-
-
-
Electroscope
chargé < 0
Lampe à vapeur de
Hg qui émet du
visible et des UV
Cas (2)
Plaque en verre
(absorbe les UV)

2
Ex1 : Calculer l’énergie associée à un photon d’un rayonnement rouge (
rouge = 0,80 m) en eV.
3. Interactions entre la lumière et la matière
a) L’effet photoélectrique : la réponse
Soit W0 le travail d’extraction d’un e- du cristal métallique. (W0 dépend de la nature du métal)
L’effet photoélectrique est observé si ……………………………………………………………………………………………………..
0
0.
Wch
est appelé : seuil photoélectrique. Dans l’expérience de Hertz,
UV ……
0 ……
visible
Généralisation : Lors de l'interaction photon-électron, trois cas sont envisageables :
1) L'énergie du photon est égale au travail de sortie de l’électron. h
= W0. L'énergie du photon suffit tout juste à expulser l'électron
hors du métal. La fréquence du photon est égale à la fréquence de seuil du métal :
s = W0 /h.
2) L'énergie du photon est inférieure au travail de sortie h
< W0. L'électron reste prisonnier du réseau métallique.
3) L'énergie du photon est supérieure au travail de sortie h
> W0. Une partie de cette énergie sert à libérer l'électron du réseau
métallique ; l'électron emporte l'excédent sous forme d'énergie cinétique Ec = h
- W0 .
Ex2 : Le travail d'extraction d'un électron du zinc est W0 = 3,3 eV.
1. Calculer la fréquence seuil et la longueur d'onde seuil du zinc.
2. On éclaire le zinc par une radiation UV de longueur d'onde
= 0,25 µm. Calculer l'énergie cinétique maximale de sortie des
électrons et leur vitesse.
3. On éclaire le zinc par la lumière d'un arc électrique en interposant une plaque de verre qui absorbe les ondes de longueur d'onde
inférieure à 0,42 µm. Un effet photoélectrique est-il observé ?
Animations : http://www.harfesoft.de/aixphysik/atom/PhotoEffect/index.html et http://www.walter-fendt.de/ph14f/photoeffect_f.htm
ou http://gilbert.gastebois.pagesperso-orange.fr/java/photo/photo.htm
b) L’effet Compton (1923)
Expérimentalement, on observe un rayonnement
diffusé (dévié) moins énergétique que le
rayonnement incident :
E’ = h
’ < E = h
’ <
Ecrire la loi de conservation de l’énergie au cours
du choc et en déduire une relation entre
’ ,
Ec(e-) et h.
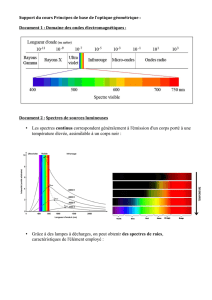
II. LES SPECTRES LUMINEUX
1. Les spectroscopes
e- « au repos »
E’ = h
’
E = h
Ec (e-)

3
Le spectre d’une lumière (sa décomposition suivant les longueurs d’ondes qui la constituent) s’effectue à l’aide d’un spectroscope
(à prismes ou à réseau).
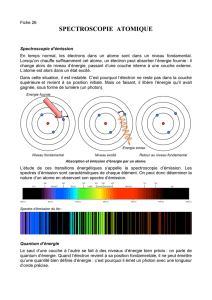
2. Les spectres d’émission
Observations : Les spectres d’émission peuvent être ……………………. (liquides ou solides chauffés) ou ……………………….
(gaz chauffés).
Un spectre d’émission discontinu est formé de ………………. fines et ……………………………… correspondant à des longueurs
d’ondes bien déterminées. Ces spectres de raies d’émission caractérisent les atomes qui les produisent.
Animation : http://www.ostralo.net/3_animations/swf/spectres.swf
3. Les spectres d’absorption
Les spectres d’absorption peuvent également être continus (solides, liquides) ou discontinus (gaz).
Les spectres d’absorption discontinus sont constitués de fines …………………………… dans le spectre continu de la lumière
blanche. Pour les atomes d’un élément donné, les raies d’absorption correspondent aux raies d’émission (mêmes λ).
Animation : http://www.ostralo.net/3_animations/swf/spectres_abs_em.swf
4. Application : identification des atomes
a) Chimie → couleurs des flammes : verte (Cu), violet (K), rose (Li), rouge (Sr), orange
(Ca), jaune (Na)…
b) Astrophysique → les spectres d’absorption des étoiles renseigne :
* sur la composition de leur atmosphère (éléments chimiques absorbant certaines radiations :
raies noires révélant leur présence)
http://www.ostralo.net/3_animations/swf/spectres_soleil.swf
* sur la température de surface de l’étoile
Ex : Soleil : jaune → 5 500°C Betelgeuse : rouge → 2 500 °C Riegel : bleue → 20 000 °C
Source de lumière
Fente
Lentille
Réseau
Image
de la
fente sur
l’écran
(1) Blanche
(2) lampe Na
(3) lampe Hg
Ecran
(1)
(2)
(3)
Vapeurs de
Na
Na
solide
Lumière blanche
Ecran
Lumière blanche
Ecran
(K+, MnO4-)

4
http://www.ostralo.net/3_animations/swf/spectres_temperature.swf
et http://subaru2.univ-lemans.fr/enseignements/physique/02/thermo/corpnoir.html
* sur le déplacement (vitesse) de l’étoile : effet Doppler (déplacement des raies du spectre vers le rouge si l’étoile s’éloigne de
nous)
III.INTERPRETATION ENERGETIQUE DES SPECTRES ATOMIQUES
1. Les niveaux d’énergie des atomes
L’énergie d’un atome est ………………………., ce qui signifie qu’elle ne peut prendre que certaines valeurs bien déterminées.
Les états correspondant à ces valeurs particulières sont appelés …………………………………… de l’atome.
Le passage d’un électron d’un niveau d’énergie à un autre est appelé ……………………………….électronique.
2. Emission et absorption d’un photon
Les transitions peuvent se faire par absorption ou émission d’un photon d’énergie E = h
a) Emission
La transition électronique d’un atome d’un niveau d’énergie supérieur (En) à un
niveau d’énergie inférieur (Ep < En) …………………… un photon d’énergie :
E = …………………………..
b) Absorption
Pour qu’un photon soit absorbé, il faut qu’il apporte l’énergie juste nécessaire à une
transition possible.
La transition électronique d’un atome d’un niveau d’énergie inférieur (E’p) à un
niveau d’énergie supérieur (E’n
E’p) se fait grâce à l’……………………….
d’un photon d’énergie E’ = …………………………….
E
E’p
E’n > E’p
Photon absorbé
e-
E
Ep
En > Ep
Photon émis
e-
E = « Energie atome » = Energie interne de cohésion du noyau + Energie d’interaction noyau / e- + Ec(e-)…
E1 : état fondamental (E1 mini : atome le + stable)
E2
E4
E3
En > E1 : états excités (instables : < 10-6 s)
E1

5
Animation : http://gilbert.gastebois.pagesperso-orange.fr/java/spectres/spectres.htm
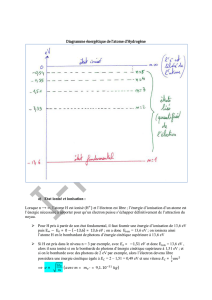
IV. APPLICATION A L’ATOME D’HYDROGENE (le plus simple, 1 p+ + 1 e-)
1. Spectre de l’atome d’hydrogène
Il y a plusieurs séries de raies (UV : série de Lyman, ; IR : série de Paschen….) mais une
seule série dans le visible → série de Balmer
4 raies visibles les plus intenses : H = 656,3 nm (rouge)
H = 486,1 nm (bleu)
H = 434,0 nm (indigo)
H = 410,2 nm (violet)
2. Niveaux d’énergie de l’atome d’hydrogène
* Par convention, E = 0 lorsque le proton et l’électron sont au repos et infiniment éloignés (sans interaction) : atome ionisé
(mais Ec(e-) = 0)
* Puisqu’il faut fournir de l’énergie pour ioniser l’atome : l’énergie de l’atome est alors toujours négative. (Cela n’est pas gênant car
ce qui est intéressant, c’est la variation d’énergie entre 2 niveaux)
La valeur de l’énergie des différents niveaux de l’atome d’hydrogène est donnée par la relation :
En = ………………….. = ………………….. n N* et est appelé nombre quantique principal.
Rem 1 : n = 1 → état fondamental
n
1 → états excités
E
0 correspond à un atome ionisé
(l’e- libéré possédant une Ec) ion H+
Rem 2 : Lorsque n augmente, les
niveaux d’énergie sont de plus en
plus resserrés
3. Les raies d’émission
La transition électronique du niveau n au niveau p (En
Ep) provoque l’émission d’une photon d’énergie : E = En - Ep = h
np
Démonstration à connaitre :
np
1
…………………………………………… avec RH = ………….. = constante de Rydberg 1,097*107 m-1
n = 1 état
fondamental
E2
E4
E3
En > E1 : états
excités
E1 = - E0
n = 2
n = 3
n = 4
- 13,6
- 3,4
- 1,5
0
n = ∞
E > 0 : atome ionisé : ion
H+
E (eV)
 6
6
 7
7
 8
8
1
/
8
100%