Documents de Physique-Chimie – M. MORIN 1

Documents de Physique-Chimie – M. MORIN
1
Thème : Observer.
Chapitre 2 : Source de lumière colorée
Cours 5 : Interaction lumière-matière
I. Interaction lumière-matière : émission et absorption.
Les interactions rayonnement-matière décrivent les effets d'un rayonnement sur l’atome.
On ne considérera ici que les interactions lumineuses avec un atome.
Il faut savoir que des rayonnements de particules (électrons) peuvent interagir avec l’atome.
Les atomes peuvent absorber certains rayonnements et en réémettre d’autres.
1. Absorption :
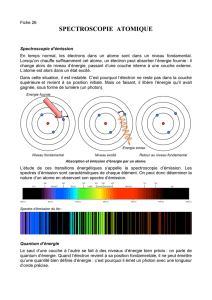
On constate que des lumières de longueurs d’onde différentes non pas le même effet sur l’atome.
- Dans la figure 1, qu’une radiation rouge (
R = 700 nm) réussit à faire changer un électron d’un niveau bas à un
niveau plus haut.
On dit que l’atome est excité car il a absorbé de l’énergie.
- Dans les figures 2 et 3, une radiation bleu (
B = 450 nm) et violette (
v = 400 nm) réussit à faire « sauter » un
électron sur des niveaux encore plus élevé.
2. Emission.
Lorsqu’un électron est passé sur un niveau plus élevé, il va tendre spontanément à retrouver son niveau initial
(appelé niveau fondamental) en émettant une radiation lumineuse.
3. Conséquences.
Les spectres correspondants à ces deux phénomènes sont des spectres d’absorption (raies noires) et
d’émission (raies lumineuses).

Documents de Physique-Chimie – M. MORIN
2
II. Quantification des niveaux d’énergie de la matière.
Dans l’expérience précédente, une condition apparaît afin qu’un électron puisse « sauter » d’un niveau à un autre.
Afin de mettre en évidence cette condition, il faut tout d’abord décrire la lumière comme un ensemble de
corpuscules.
1. Modèle corpusculaire de la lumière : le photon.
Nous avons vu en classe de 2nde que la lumière peut être décrite comme une onde électromagnétique. C'est-à-
dire qu’elle peut se propager sans milieu matériel.
1905
Einstein introduit la notion de photon. Les photons sont des « paquets » d'énergie élémentaires appelés
"quanta".
2. Energie du photon.
Chaque photon transporte une énergie E = h
E s’exprime en Joule
est la fréquence (Hz)
h est une constante universelle appelée constante de Planck. h = 6,62 × 10-34 J.s
Autre expression de l’énergie transportée par un photon :
La fréquence est l’inverse de la période T or T =
donc
=
e
alorsE=
s'exprime en mètre (m).
c est la célérité de la lumière dans le vide. c = 3,0 x 108 m.s-1
Exemple de calcul d’énergie transportée par un photon :
Un photon « rouge » a une longueur d’onde
= 700 nm.
Il se déplace à la vitesse de la lumière c = 3,0 x 108 m.s-1
E=
2,8 × 10-19 J
On constate que la valeur est très petite.
Les physiciens utilisent une autre unité pour les énergies transportées par des particules : l’électron-volt (eV).
Un électron-volt est l’énergie d’un électron soumis à une tension de 1,0 V.
1 eV = 1,6 × 10-19 J
Alors l’énergie transportée par le photon rouge est E =
1,8 eV.

Documents de Physique-Chimie – M. MORIN
3
3. Echange d’énergie avec un photon.
Niels Bohr en 1913 émis les hypothèses suivantes :
L'énergie de l'électron est fixée et ne prend que des valeurs précises (on dit qu’elle est quantifiée).
Les radiations ne sont émises ou absorbées que si un électron passe d'une orbite à l'autre. (transition
électronique).
Par convention, les énergies des électrons sur les différentes orbites sont négatives.
Par convention, L’énergie de l’électron situé sur la plus basse orbite a la valeur la plus négative. On appelle cet
état, l’état fondamental E0. Dans cet état, l’électron est particulièrement stable car très lié au noyau.
Quand les électrons sont sur des orbites plus éloignées du noyau, ils sont dans des états excités. Leurs niveaux
énergies ont des valeurs comprises entre E0 et 0.
Ces niveaux d’énergie sont quantifiés, c'est-à-dire qu’ils ont des valeurs discrètes (discontinues).
Un électron qui n’est plus rattaché au noyau a une énergie égale à 0.
Exemple de schémas représentant les niveaux énergies des électrons sur les différentes orbites de l’atome de
mercure.
Problème :
Un atome de mercure passe d'un niveau énergétique E1 = -4,99 eV à un niveau E = -10,44 eV.
a- L'atome perd-il ou gagne t-il de l'énergie ?
Réponse : Il perd de l’énergie, il devient plus stable.
b- Cette transition énergétique s'accompagnera-t-elle d'une émission ou d'une absorption d'une radiation
lumineuse ?
Réponse : Cette transition électronique s’accompagne d’une émission de lumière.
c- Quelle est la valeur de la différence d’énergie E entre ces deux niveaux d’énergies ?
Réponse : E = 10,44 – 4,99 = 5,5 eV.
d- Quelle est la valeur de la longueur d'onde de cette radiation lumineuse ?
Réponse :
E =
alors
=
2,3 × 107 m = 230 nm.
e- Est-elle visible ? Rappel : domaine visible [400 nm (violet) – 780 nm (rouge)]
Réponse : La radiation lumineuse n’est pas visible 230 nm < 400 nm. Il s’agit d’un rayonnement ultraviolet.

Documents de Physique-Chimie – M. MORIN
4
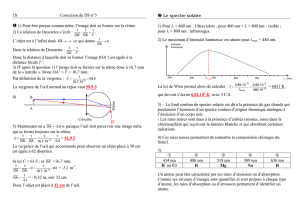
III. Spectre solaire.
1. Obtention d’un spectre continu.
2. Obtention d’un spectre d’absorption.
3. Le spectre solaire.
Le spectre solaire fait apparaître un spectre d’émission continu sur lequel se superpose un spectre
d’absorption.
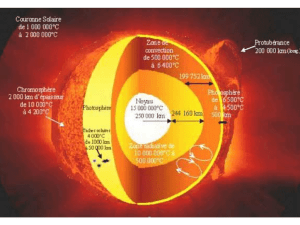
Le spectre d’émission continu a pour origine le centre très chaud du Soleil. (15 000 000 °C).
Le spectre d’absorption a pour origine le passage de la lumière blanche issu du centre du Soleil à travers
l’atmosphère (Photosphère) relativement plus froide (6 000 °C) contenant des éléments chimiques.
Chaque petite raie noire correspond à une raie d’absorption.
La présence de raies caractéristiques d’un élément chimique permet mettre en évidence la présence de celui-ci dans
l’atmosphère de l’étoile.
L'analyse des raies d'absorption dans le spectre d'une étoile nous renseigne sur :
la température de sa surface
la taille et la distance de l'étoile
sa vitesse relative à nous
la composition chimique de son atmosphère
sa rotation sur elle-même
son champ magnétique
de la matière interstellaire sur la ligne de visée
1
/
4
100%