F – ß-bloquants (en augmentant la dose progressivement)

1/19
Pascal Chaumont et Mélanie Le Hô
06/10/12
Pharmacologie, Pharmacologie de l'angor et de l'insuffisance cardiaque, Pr BELLISSANT ERIC
Diapo dispo sur le réseau pédagogique (diapo de l'année dernière encore d'actualité cette année)
Pharmacologie de l'Angor
I- Physiologie de la circulation coronaire
Les facteurs déterminants la consommation en oxygène du myocarde (MVO2) sont:
- FC (le plus gros consommateur)
- Tension Pariétale du ventricule gauche.
Elle dépend de :
* la pression intraventriculaire de remplissage (précharge)
* la pression intraventriculaire d'éjection (postcharge) : augmente notamment en cas d’HTA
* volume ventriculaire
* épaisseur de la paroi ventriculaire
- Contractilité
- Durée d'éjection systolique
Donc, plus ces facteurs augmentent, plus la MVO2 augmente.
Le débit coronaire Qco = 5% du QC (débit cardiaque)
L'extraction de l'O2 est de 75%.
Ainsi, l'augmentation des besoins en O2 n’est satisfaite que si le débit augmente, sinon déficit.
II- Physiopathologie de l'Angor
L’angor correspond à un déséquilibre entre besoins et apports en O2 au niveau du myocarde,
avec les besoins qui deviennent supérieurs aux apports.
Les causes :
* Athérosclérose : empêche la vasodilatation
=> Angor d'effort (la douleur apparaît toujours pour le même niveau d'effort)
Ici, le débit n’augmente pas avec l’augmentation des besoins en O2 du myocarde.

2/19
* Spasme des artères coronaires soit saines, soit athéromateuses
=> Angor de repos = Angor de Prinzmetal (apparaît surtout la nuit, le débit au repos est
insuffisant pour assurer la MVO2 de repos)
2 types d'angor :
- Angor stable (effort ou repos) : importance de l'athérome et/ou des spasmes
- Angor instable : importance des plaquettes dans la physiopathologie (risque de thrombose). On est dans
un stade entre angor stable et infarctus du myocarde. L'angor instable est une crise d'angor qui se
prolonge et tend à évoluer vers un infarctus. A traiter de façon urgente !
III- Pharmacologie du traitement de l'angor
A - Bases pharmacologiques
Angor stable:
* Augmentation des apports (chirurgie : pontage, dérivation veineuse) :
- difficile : le débit et la vasodilatation coronaires sont déjà au maximum
- problématique : Vol Coronaire (vasodilatation en territoire sain des artères
coronaires non athéromateuses = le sang est détourné vers les territoires sains et les
artères coronaires n’irriguent pas assez les territoires non sains, ce qui peut entrainer
infarctus ou angor. Dérivation supplémentaire du sang vers des territoires déjà
correctement irrigués au dépend des territoires malades du fait d'une meilleur
réponse des territoires sains, ce qui aggrave la maladie)
* Diminution des besoins : anti-angoreux actuels
Angor instable: idem que l'angor stable + traitement anticoagulant (sinon thrombose puis infarctus)
B - Médicaments utilisés contre l'angor
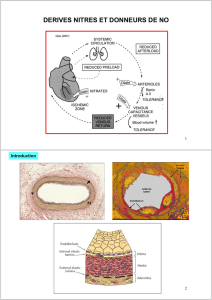
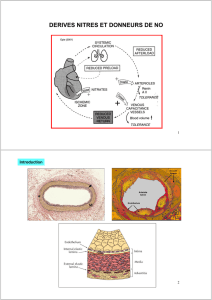
1-Dérivés nitrés
Trinitrine ou Tinitroglycérine
a - Propriétés
Test diagnostic: si avec la trinitine, la douleur passe alors c'est un angor sinon c'est un infarctus.
La trinitrine entraîne une relaxation des fibres musculaires lisses vasculaires par action directe.

3/19
b - Mécanismes
Les mécanismes de cette relaxation sont :
- stimulation de la guanylate cyclase : augmentation du GPMc (entraine un relaxation des FML comme
lors d’une augmentation de l’AMPc)
- inhibition de la thromboxane synthétase : augmentation de la synthèse de PGI2 qui elle aussi est
vasodilatatrice.
La trinitrine va donc entraîner une vasodilatation généralisée touchant autant (même plus) le système
veineux que le système artériel (alors que les autres médicaments agissent uniquement sur les artères).
c - Effets
- Vasodilatation veineuse : baisse de la pression de remplissage (pré charge) et du volume du VG
- Vasodilatation artérielle : baisse de la post charge et du temps d'éjection du VG
- Baisse de la PA donc augmentation de la fréquence cardiaque et de la contractilité réflexes donc
augmentation de la MVO2 (le développement de ces systèmes va donc à l’encontre de l’objectif du
traitement)
- Vasodilatation coronaire en IV ou en intracoronaire (principalement lorsqu’on donne la
nitroglycérine par voie veineuse ou coronaire ; phénomène pas évident quand on la donne par voie orale)
Si une trop forte dose est administrée, les effets favorables diminuent par l'augmentation de la FC (à cause
de la diminution de la PA)
d - Pharmacocinétique
Résorption:
- voie sublinguale : rapide, biodisponibilité importante (70-80%), sert de test diagnostic,
parfaitement adapté à la crise d'angor.
- voie orale : plus lente, effet de 1er passage hépatique (destruction partielle) ,
biodisponibilité = 10-20%.
- Phénomènes saturables et augmentation de la biodisponibilité avec la dose.
Métabolisme hépatique
Élimination rénale : ½ vie de 20min
Délai et durée d'action:
- sublinguale : début 1-2min / durée 30min
- orale : début 20min / durée 30min (ou +)
puis en traitement chronique:
- transcutanée : pas de premier passage hépatique, effet plus long (toute la journée).
- IV phase aiguë de l'IDM (utilisé en Unité de Soin Intensif), décompensation de l'IC chronique
(ICC), l'effet dure le temps de la perfusion.
On ne peut pas utiliser les nitrés au delà d'une dose qui fait baisser la PA.

4/19
e - Effets (résumé)
f - Effets indésirables
- Rougeur du visage,céphalées
- Hypotension orthostatique
- augmentation de la tension intraoculaire
Contre indication : Myocardiopathie obstructive
g - Utilisation thérapeutique
- Crise angineuse
- Traitement curatif par voie sublinguale
- Traitement préventif à prendre avant la cause déclenchant l'effort
h - autres dérivés nitrés
- DNIS (dinitrate d'isosorbide) (le plus utilisé) , MNIS (mononitrate d'isosorbide ) (voie orale) Même
indication que la trinitrine, utilisé dans les crises angineuses, en traitement de fond de maladie
coronarienne, et en urgence)
- PETN (penta ---truc –> on s'en fout)
- Molsidomine ( Corvasal)

5/19
2 - Béta-bloquants
Première indication historique dans le traitement de l'angor.
a - Propriétés
- Baisse la FC (baisse MVO2)
- Baisse la contractilité (baisse MVO2)
- Baisse la conduction AV
- Redistribution du sang au profit des zones sous-endocardiques
=> anti-angineux
b - utilisation thérapeutique
Tous les béta-bloquant ont un effet anti-angoreux équivalent. Il faut augmenter les doses de façon
progressive jusqu'à:
- l'effet thérapeutique
- une bradycardie de repos <50/min
Utilisé en traitement de fond de maladies coronariennes, mais pas pour une crise d'angor car le temps que
les bétabloquants agissent...le patient a de grandes chances de s'envoler.
Associé à la trinitrine en cas de crise douloureuse, ils baissent la tachycardie et diminuent l'effet inotrope
+. Ce qui diminue les effets indésirables de la trinitrine notamment = effet synergique.
Il ne faut pas interrompre brutalement les bétabloquants !
Effets → Dans l'angor stable : ils baissent le nombre de crise et augmente la tolérance à l'effort.
Pas d'effet dans l'angor spastique.
Dans l'angor instable, ils baissent le risque d'IDM
En prévention secondaire, ils diminuent la mortalité de 20% au cours de la 1ére année suivant un
IDM.
Les dérivés nitrés sont utilisés dans le traitement de la crise angineuse et la prévention tandis que
les bétabloquants sont utilisés pour le traitement au long court.
3 - Les antagonistes calciques
- Vérapamil , isoptil® (utilisé aussi contre l'hypertension)
- Diltiazem, Tildiem® (utilisé aussi contre l'hypertension)
- Bépridil, Cordium® (= antagoniste calcique pur, pas utilisé dans les traitement antihypertenseurs,
spécifique à l'angor)
- Nifédipine, Adalate® (utilisé aussi contre l'hypertension)
a - propriétés
- Blocage de l'entrée du Calcium à travers les canaux VOC des cellules cardiaques contractiles, du tissu
nodal et vasculaire.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%