8 Groupes caractéri..

Chap 8 : GROUPES CARACTERISTIQUES ET REACTIVITE 1ère S
I] Groupes caractéristiques.
1. Définition.
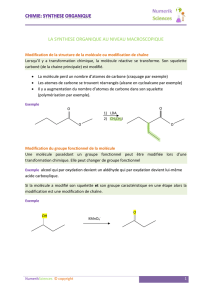
Ds une molécule organique, on appelle groupes caractéristiques tous ceux qui correspondent à des liaisons autres que simples
entre C et H.
Ex : but-1-ène : les deux C sont reliés par une double liaison et constituent le groupe caractéristique.
Le groupe caractéristique de la molécule lui confère l'appartenance à une famille ainsi que des propriétés caractéristiques.
Pour reconnaître la famille à laquelle une espèce chimique appartient, il y a deux possibilités :
On identifie le groupe caractéristique à partir de la formule correspondant à l'espèce .
On cherche à mettre en évidence, par un test , une des propriétés caractéristiques de l'espèce chimique considérée.
2. Les principales familles chimiques.

3. Nomenclature.
Le nom des espèces chimiques possédant un groupe caractéristique est constitué selon les cas par un radical auquel on a adjoint un
préfixe, et / ou un suffixe.
Famille
Genre
Suffixe
Préfixe
Alcool
masculin
ol
(hydroxy)
Composé halogéné
masculin
/
chloro, bromo, iodo
Cétone
féminin
one
(oxo)
Aldéhyde
masculin
al
(oxo)
Acide carboxylique
masculin
oïque
(carboxy)
NB : les préfixes entre parenthèses dans le tableau ne s'utilisent que dans le cas de molécules possédant plusieurs groupes
caractéristiques. Ex : acide 2-aminopropanoïque.
Dans numéros indiquent la position du groupe caractéristique et des ramifications du squelette carboné.
Le sens de la numérotation des atomes de la chaîne carbonée doit être tel que la position du groupe caractéristique soit minimale.
Ce sens impose la numérotation des ramifications.
Lorsqu'un groupe caractéristique est présent plusieurs fois dans une même molécule, on utilise les termes di, tri, …
Suivant les cas, le groupe caractéristique est indiqué dans le nom de l'espèce chimique en préfixe ou en suffixe.
Ex 1: éthanol. Ex 2 : dichlorométhane.
Ex 3 : butanal. Ex 4: acide éthanoïque.
La nomenclature des amines diffère légèrement. Le radical étant souvent "amine", le nom méthylamine est préféré au nom
aminométhane qui n'est plus utilisé.
4. Utilisation des écritures topologiques.
Les conventions vues pour les alcanes s'appliquent. Les atomes de C et H sont obligatoirement indiqués ainsi que les atomes H qui
leur sont attachés.
II] Réactivité des alcools.
1. Oxydation.
Les alcools, dont le carbone portant le groupe caractéristique – OH porte également un atome H, peuvent être oxydés par l'ion
permanganate. Il s'agit d'une oxydation ménagée car le squelette carboné est conservé pendant la réaction.
La forme réduite du couple possède le groupe caractéristique C – O – H. La forme oxydée possède le groupe C = O. C'est donc,
suivant les cas, un aldéhyde ou une cétone.
Ex : CH3CH2OH(aq) = CH3CHO(aq) + 2 H+(aq) + 2 e-
MnO4–(aq) + 8 H+(aq) + 5 e- = Mn2+(aq) + 4 H2O
5 CH3CH2OH(aq) + 2 MnO4–(aq) + 8 H+(aq) 5 CH3CHO(aq) + 2 Mn2+(aq) + 8 H2O
Cette réaction sert de test caractéristique des alcools : décoloration de la solution de permanganate de potassium. En outre, la
formation de l'aldéhyde ou de la cétone peuvent être mis en évidence par le test à la 2,4-DNPH effectué sur le système final.
NB : l'aldéhyde peut lui-même être oxydé en acide carboxylique.
NB' : tous les alcools peuvent brûler. La combustion ne préserve pas le squelette carboné. Ce n'est donc pas une oxydation ménagée.
2. Déshydratation.
Une déshydratation est une réaction au cours de laquelle une molécule d'eau est produite. Une molécule d'alcool peut se
déshydrater en éliminant les atomes O et H de son groupe caractéristique et un atome H d'un carbone voisin. Il se forme un
alcène.
La déshydratation est 1 cas particulier de réaction d'élimination dont la
particularité est de modifier sérieusement le squelette carboné.
Ex : C4H9–CH2–CH2–OH C4H9 – CH = CH2 + H2O
L'alcène formé peut être mis en évidence par un test au dibrome
caractéristique de la famille des alcènes.
Modification de la géométrie : les atomes C tétraédriques deviennent plans.
Modification des liaisons : le squelette ne possède initialement que des
liaisons simples tandis qu'à la fin, il a une double liaison.
3. Substitution.

Au cours d'une réaction de substitution, un groupe d'atome est remplacé par un autre groupe ou par un autre atome. Les
alcools peuvent subir une telle transformation; leur groupe caractéristique – OH peut, par exemple, être remplacé par un
halogène.
Ex : réaction du méthylpropan-2-ol avec l'acide chlorhydrique :
C4H9–OH + H+(aq) + Cl-(aq) C4H9–Cl + H2O
Pour mettre en évidence le composé halogéné résultant de la
réaction de substitution par un test au nitrate d'argent alcoolique,
il est indispensable d'isoler le produit formé / Cl-. Comment ?
III] Passage d'un groupe caractéristique à un autre.
1. Chimie créatrice.
Grâce au passage d'un groupe caractéristique à un autre, la chimie organique est une chimie créatrice de nouvelles molécules.
2. Chimie industrielle du méthanol.
Le méthanol est transformé industriellement en d'autres produits de base de l'industrie par réaction de substitution ou d'oxydation.
En outre, par déshydratation intermoléculaire avec le méthylpropan-2-ol, on obtient le MTBE C5H12O (méthyltertiobutyléther),
principal additif des essences : CH3OH + C4H9OH CH3–O–C4H9 + H2O
1
/
3
100%