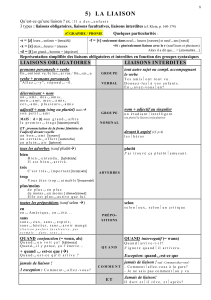
Liaisons faibles et biomolécules

Liaisons faibles et biomolécules
Introduction :
L’analyse chimique des êtres vivants montre qu’au niveau moléculaire les composés qui les constituent
se répartissent en un petit nombre de catégories : l’eau, les lipides, les glucides, les acides aminés et les
nucléotides ; ces 2 dernières catégories étant présentes très souvent sous forme de polymères respectivement les
protides et les acides nucléiques. Dans ces composés, la majorité des liaisons entre atomes sont des liaisons de
type covalente, c’est à dire des liaisons dans lesquelles les atomes se partagent les électrons.
Bien que ces liaisons soient fondamentales, puisqu’elles permettent par exemple la construction de
grands édifices que l’on nomme macromolécules, la chimie du vivant est également caractérisée par un ensemble
d’interactions entre atomes d’une même molécule ou de molécules différentes ; ces interactions de nature diverse
mais toutes basées sur l’attraction entre charges électriques sont appelées des liaisons faibles et elles se
regroupent généralement en trois catégories* : les liaisons hydrogènes, les liaisons ioniques et les interactions
hydrophobes dans lesquelles on incluera les forces de Van der Waals. Les biomolécules peuvent être définies
comme des molécules présentes dans l’organisme et produites par le vivant, on excluera ainsi l’eau qui bien que
constituant moléculaire majoritaire du vivant n’est pas le résultat de son activité.
Comment les propriétés de ces liaisons régissent elles l’organisation des structures biologiques ainsi que les
interactions entre molécules nécessaires au fonctionnement intégré de l’organisme ?
La démarche propose de s’intéresser dans un premier temps au rôle structural des liaisons faibles puis dans un
second temps à leur implication dans les interactions rapides qu’exigent les divers aspects de la vie cellulaire.
PLAN POSSIBLE :
1. Les différentes liaisons faibles assurent la stabilité d’assemblages
moléculaires :
2-1 Les liaisons faibles assurent la cohésion intramoléculaire :
Rappeler les expériences de dénaturation ; la température, le pH excessifs peuvent entraîner une perte des
fonctions des protéines sans pour autant que les liaisons covalentes entre atomes ne soient rompues.
Prendre l’exemple de l’hémoglobine et présenter les différents niveaux structuraux , les liaisons faibles
interviennent dès la structure secondaire (les hélices ), montrer la poche hydrophobe où se loge le groupement
hème, l’existence d’une structure quaternaire où les molécules de globine sont associées entre elles par des ponts
salins (liaisons ioniques).
Rappeler l’existence de liaisons H chez les molécules de réserves de nature osidique.
Autre exemple susceptible d’être développé, la molécule d’ADN où les liaisons H entre bases complémentaires
permettent l’association des 2 brins et stabilisent la double hélice.
2-2 Les liaisons faibles assurent l’assemblage entre molécules :
a) la construction d’édifices supramoléculaires :
ex : la membrane plasmique
Technique du FRAP
Le grand nombre d’interactions hydrophobes et de liaisons Van der Waals permet la cohésion importante de
l’édifice mais n’interdit pas pour autant une certaine fluidité (modèle de la mosaïque fluide) et autorise la
diffusion de composés hydrophobes ou de taille réduite.
D’autres exemples peuvent être cités sans développer : acides nucléiques et chromatine, lipoprotéines,…
b) la cohésion d’édifices extracellulaires :
exemple : la paroi de la cellule végétale ou la cuticule des Arthropodes
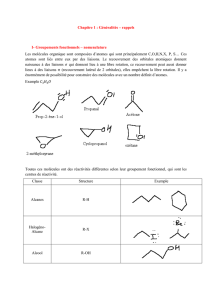
Les biomolécules sont constituées à partir d’un squelette carboné, des liaisons covalentes assurent la
configuration de ces molécules
Stables dans le temps et nombreuses, « l’union fait la force », ces liaisons ont un rôle structural fondamental
permettant d’assurer la cohésion intra et intermoléculaire.

Elles sont également impliquées dans des interactions à court terme mettant le plus souvent en jeu des protéines
et un ligand.
2. Les liaisons faibles permettent des interactions réversibles entre
biomolécules :
Leur facilité de rupture ou de formation va permettre l’entretien de la fluidité, de la flexibilité nécessaire au
maintien de l’activité biologique.
2-1 Les complexes enzyme substrat
- A partir d’un exemple de relation Vi en fonction de S
Les liaisons faibles qui s’établissent entre enzyme et substrat sont rapides, spécifiques et réversibles , soumises à
un contrôle ; elles répondent bien aux exigences des réactions du métabolisme qui s’effectuent dans un
organisme. Définir Vm et Km.
On pouvait d’autre part signaler l’existence des enzymes allostériques, les changements d’affinité des sites actifs
étant dues là encore à des liaisons faibles .
3-2 Des reconnaissances cellulaires sont permises grâce aux liaisons faibles
Dans cette partie doivent être signalés d’autres exemples d’interactions protéines ligands et les conséquences de
ces interactions à savoir modification de l’activité de la cellule : cinétique d’absorption du glucose par GluT1 ,
fonctionnement de la pompe H+-ATPase .
.
Conclusion : Les implications des liaisons faibles pour l’organisation du monde vivant sont nombreuses et
variées. Elles conditionnent l’organisation tridimensionnelle des biomolécules complexes et des assemblages
moléculaires. Elles sont au cœur des processus vitaux grâce aux interactions réversibles entre molécules qu’elles
permettent de réaliser et dont les conséquences sont multiples. L’existence des liaisons faibles qui participent à
la conformation des molécules et en particulier des protéines montre une fois de plus l’importance de la relation
structure fonction à l’échelle moléculaire ici.
.
Les liaisons faibles grâce à leur grand nombre , leur diversité seront à l’origine des conformations des molécules
dans leur environnement. Leur facilité de rupture ou de formation va permettre l’entretien de la fluidité, de la
flexibilité nécessaire au maintien de l’activité biologique.
*Bref rappel sur les liaisons faibles
a) les forces ioniques : elles résultent de l’attraction entre molécules chargées ; de telles liaisons sont
fréquentes chez les protéines du fait de la présence des chaînes latérales chargées de certains acides
aminés. (ex . attraction -COO HN- )
b) les liaisons hydrogène : elles se forment quand un atome d’hydrogène est lié de façon covalente à un
atome fortement électronégatif comme l’oxygène, ce dernier tend à capturer l’électron de l’hydrogène
qui acquiert alors une légère charge positive et se trouve ainsi attiré par une molécule chargée
négativement. Elles sont responsables des propriétés de solvant de la molécule d’eau, les molécules
polaires chargées ou non pourront établir des liaisons H avec les molécules d’eau. D’après le document

1, elles sont plus faibles que les précédentes cependant elles se singularisent par le fait qu’elles sont
directionnelles et induisent une orientation des atomes impliqués.
c) les forces de Van der Waals : ce sont des interactions entre molécules indépendantes à couches
électroniques complètes, ce sont les plus faibles de toutes et nécessitent une proximité importante entre
les molécules pour s’établir. (ex. cohésion entre les chaînes hydrocarbonées des lipides membranaires).
d) les interactions hydrophobes : elles existent pour les molécules ou groupements non polaires qui
tendent à s’associer entre eux lorsqu’ils sont en milieu aqueux ; cette association est plus stable
énergétiquement.
1
/
3
100%