Liaisons fortes-faibles219.46 KB

1
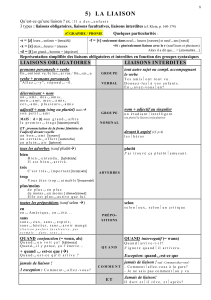
LIAISONS FORTES-FAIBLES
I/Les liaisons hydrogènes.
C’est une interaction électrostatique entre un atome électronégatif et un H lié à un autre atome.
Ce sont des liaisons intermoléculaires entre deux molécules (intramoléculaires si le cycle le permet).
L’interaction électrostatique (<40kJ):
- Se fait le long d’un doublet non liant (OHO=180°).
- Augmentée par :
L’augmentation de l’électronégativité (atomes lourds : F>O).
l’agrandissement du rayon atomique.
- Diminuée par l’augmentation de la masse atomique (gaz volatil).
Liaison hydrogène formée par une polarisation des liaisons.
II/Liaisons fortes-faibles.
Les interactions charge-dipôle sont plus faibles que les liaisons charge-charge car elles dépendent
d’une fonction 1/r² tandis que les charge-charge dépendent de 1/r.
Il y à attraction entre le nuage électronique d’une molécule et les noyaux des autres molécules.
Il y à répulsion des noyaux des deux molécules comme de leur nuage électronique.
Les interactions dipôle-dipôle dépendent de 1/r6 et sont encore plus faibles, ce sont des liaisons
courtes qui stabilisent grâce à leurs interactions répulsives ou attractives.
Lorsque deux molécules se rapprochent il apparait une force répulsive (orbitales pleines : De Pauli).

2
III/Chimie de coordination.
Complexe formé par un métal entouré de ligands cycliques, le nombre de coordination
corresponde au nombre de ligands entourant le centre métallique (plus communs 6 et 4).
Le métal interagit avec les ligands au travers des orbitales d.
Les ligands présentent aux orbitales du métal :
- Leurs doublets libres.
- Leurs atomes chargés.
Le métal central est chargé positivement tandis que les ligands sont négatifs ou neutres.
Théorie du champ cristallin et du champ des ligands :
La nature du métal et des ligands va influer sur la configuration de la levée de dégénérescence.
Types de liaisons:
- Liaisons fortes
Covalentes.
Ioniques.
Métalliques.
- Liaisons faibles
Hydrogènes.
Van der Waals.
Ex : Le Fe dans
l’hémoglobine.
4 directions équatoriales.
2 directions axiales.
1
/
2
100%








![[ ][][ MLn L M 10.3,6 ]) ([ ] [] [ = × = NH Ag NH Ag Kd](http://s1.studylibfr.com/store/data/002601672_1-57de8b0d2e37b3f5af3073b29cc142bc-300x300.png)