I. Réactions chimiques

15/04/2017 769795113 1/2
NOM : ................................................
Prénom : ................................................
Classe : 1ère S ….
Chimie
Réactions chimiques et formules chimiques
AP
Source : P. Schwaederlé
I. Réactions chimiques
1. Rappels
Une réaction chimique a lieu lorsque la ou les entités de départ (atomes, ions ou molécules) se transforment
pour donner une ou plusieurs autres entités. Le lieu de la réaction est appelé REACTEUR.
Les entités de départ sont appelées :
REACTIFS
Les nouvelles entités produites par la
réaction sont appelées : PRODUITS
Remarque : Une équation chimique
doit être équilibrée. Les coefficients
stœchiométriques doivent être tels qu’on
retrouve toujours autant d’atomes de
chaque élément chimique avant et après
la réaction.
Exercices : Equilibrer les équations bilans suivantes :
a) ............ H2 + ............ N2 NH3
b) ............ C6H12O6 + ............ O2 ............ CO2 + ............ H2O
c) ............ CO2 + ............ H2 ............ CH4 + ............ H2O
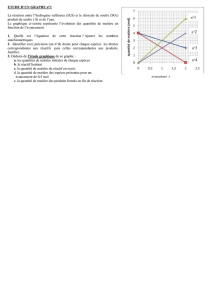
2. Le tableau d’avancement
Le tableau d’avancement permet de connaître la quantité de produits formés au cours d’une réaction mais aussi
de savoir si l’un des réactifs n’a pas été introduit en quantité insuffisante (réactif en défaut).
Exercice 1 : On fait réagir 3 mol de dioxyde de carbone avec 5 mol d’ammoniac.
a) Compléter le tableau d’avancement.
équation-bilan
CO2 + 2 NH3 CO(NH2)2 + H2O
Etat initial
x = 0
en cours
x
Etat final
x = xmax
b) Déterminer l’avancement maximal de la réaction
.........................................................................................................................................................................
.........................................................................................................................................................................
c) Déterminer la composition finale (en mol) du réacteur.
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
d) La quantité de matière s’est-elle conservée lors de la réaction chimique ? Justifier.
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................

15/04/2017 769795113 2/2
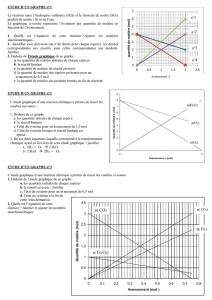
2.1. Exercice 2 : On brûle 2 mol de butane C4H10 dans 6,5 mol de dioxygène. Il se forme de l’eau et du dioxyde
de carbone.
Masses molaires : M(C4H10) = 58 g.mol-1 ; m(O2) = 32 g.mol-1 ; M(H2O) = 18 g.mol-1 ; M(CO2) = 44 g.mol-1
a) Calculer la masse initiale de butane
.........................................................................................................................................................................
b) Calculer la masse initiale de dioxygène
.........................................................................................................................................................................
c) Compléter ci-dessous l’équation bilan de la réaction chimique qui se produit lors de cette combustion.
d) A l’aide d’un tableau d’avancement, déterminer le réactif limitant. Détailler votre raisonnement.
équation-bilan
............ C4H10 + ............ O2 ............ H2O + ............ CO2
Etat initial
x = 0
en cours
x
Etat final
x = xmax
e) Calculer les masses d’eau et de dioxyde de carbone obtenues.
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
f) Calculer la masse restante du réaction en excès
.........................................................................................................................................................................
.........................................................................................................................................................................
.........................................................................................................................................................................
g) La masse est-elle conservée lors d’une réaction chimique ? Justifier votre réponse.
.........................................................................................................................................................................
.........................................................................................................................................................................
..........................................................................................................................................................................
II. Formules chimiques des composés ioniques
Les composés ioniques sont, comme leur nom l’indique, composés d’ions. Un composé ionique étant toujours
électriquement neutre, il contient forcément au moins un ion positif (cation) et au moins un ion négatif (anion).
Exemple :
Le sel de cuisine est appelé chlorure de sodium (formule NaCℓ). Il est composé du cation Na + et de l’anion Cℓ-.
Lorsque ces deux ions de signes opposés s’attirent et se rapprochent, leur charge s’annule et l’on obtient le
composé solide et neutre NaCℓ.
Exercice : Compléter l’équation de la formation des composés ioniques suivants :
1) ............ K+ + ............ I- ................................................
2) ............ K+ + ............ S2- ................................................
3) ............ NH4+ + ............ Cℓ- ................................................
4) ............ Fe3+ + ............ Cℓ- ................................................
5) ............ Aℓ3+ + ............ SO42- ................................................
6) ............ Fe2+ + ............ SO42- ................................................
7) ............ Aℓ3+ + ............ O2- ................................................
8) ............ Zn2+ + ............ PO4…. Zn3(PO4)2
1
/
2
100%