Dégradation du complexe Cdk2/cycline A par le protéasome et

Matthieu STIERLE
Dégradation du complexe
Cdk 2/cycline A par le protéasome
et implication dans le cancer
Master EGPR 2004-2005

SOMMAIRE
RÉSUMÉ 1
INTRODUCTION 1
LE PROTÉASOME 1
LE COMPLEXE CDK2/CYCLINE A ET LE CYCLE CELLULAIRE 2
LES RÉGULATIONS EXERCÉES PAR LE COMPLEXE CDK2/CYCLINE A 4
LA RÉGULATION VIA LA PHOSPHORYLATION DES FACTEURS DE TRANSCRIPTION E2F 4
LA RÉGULATION VIA LA PHOSPHORYLATION DE LA PROTÉINE RB4
LA DÉGRADATION DU COMPLEXE CDK2/CYCLINE A DANS LES CELLULES
CANCÉREUSES 5
INHIBITION DU COMPLEXE CDK2/CYCLINE A DANS LES CELLULES CANCÉREUSES 5
LA DÉGRADATION DU COMPLEXE CDK2/CYCLINE A DANS LES CELLULES CANCÉREUSES 6
CONCLUSIONS 8
RÉFÉRENCES 10
FIGURES 11

1
Résumé
Les stratégies modernes pour le traitement du cancer tendent à cibler
spécifiquement les cellules tumorales en essayant de minimiser les effets
secondaires sur les cellules saines. Une des stratégies récemment développées
consiste à cibler le complexe Cdk2/cycline A pour l’inhiber ou le dégrader. Cette
stratégie a montré que l’inhibition du complexe Cdk2/cycline A à l’aide d’un peptide
compétiteur (peptide RLX : domaine de liaison de la cycline A présent sur les
facteurs de transcription E2F) induit une inhibition spécifique de la croissance
tumorale. D’autres expériences qui visent à détruire le complexe Cdk2/cycline A par
la voie ubiquitine/protéasome ont donné des résultats encore plus prometteurs : in
vitro, on observe un phénomène d’apoptose spécifique des cellules tumorales et in
vivo, il y a une inhibition spécifique de la croissance tumorale sans qu’il y ait des
effets secondaires notables pour les cellules saines.
Mots-clés : Cdk2/cycline A ; protéasome ; cancer ; E2F ; pRb
Introduction
Le protéasome
Les protéines qui assurent l’essentiel des fonctions cellulaires, sont
synthétisées en permanence pour renouveler le stock de molécules actives.
Cependant, le processus inverse, la dégradation protéique, est tout autant une
nécessité pour la cellule : d’une part, pour que les nouvelles protéines s’ajoutent au
stock existant sans modifier l’équilibre cellulaire ; d’autre part pour éliminer les
protéines mal repliées par suite de mutations génétiques ou de stress thermiques ou
oxydatifs. La dégradation détermine ainsi la durée de vie et la concentration de
nombreuses enzymes et protéines régulatrices (cyclines, kinases impliquées dans le
cycle cellulaire, facteurs de transcription,…). De même, le fonctionnement du
système immunitaire repose en partie sur la reconnaissance de peptides
immunocompétents, les antigènes, issus de la dégradation de protéines d’origine

2
endogène ou exogène et présentés aux lymphocytes T via le complexe majeur
d’histocompatibité de classe I ou II.
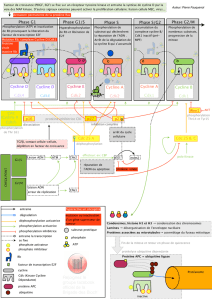
La majorité de ces activités est assurée chez les eucaryotes par le système
ubiquitine/protéasome 26S [1•] (figure 1), qui utilise l’ubiquitine pour marquer les
protéines à dégrader et le protéasome en tant qu’enzyme protéolytique
reconnaissant les substrats poly-ubiquitinés. L’ubiquitination des protéines à
dégrader est assurée par trois types d’enzymes : E1, E2 et E3. E1 (ubiquitine
transactivase) active l’ubiquitine en formant avec elle un thiol-ester, et la transmet à
E2 (ubiquitine conjugase), qui également fixe l’ubiquitine par un thiol-ester. E2
ensuite, soit par l’intermédiaire de E3 (ubiquitine ligase), soit avec E3, transfère
l’ubiquitine sur le substrat. Le protéasome, complexe multicatalytique de forme
cylindrique, est présent dans le noyau et le cytoplasme de toutes les cellules
eucaryotes [2]. L’activité protéolytique est portée par le complexe protéique appelé
protéasome 20S et est régulée par deux particules régulatrices appelés complexes
19S. L’association d’un protéasome 20S avec deux complexes multimériques 19S
est nommée protéasome 26S.
Ces dernières années, l’étude du protéasome 26S est devenue un domaine
de recherche particulièrement actif. Des études ont montré que le protéasome 26S
est impliqué dans la régulation de processus cellulaires importants via la dégradation
de protéines intracellulaires impliquées dans la division cellulaire (topoisomérases I
et II), la progression dans le cycle cellulaire (cyclines, inhibiteurs de Cdk), la
régulation de la transcription (Fos/Jun), l’apoptose (Bcl-2)…[3].
Le complexe Cdk2/cycline A et le cycle cellulaire
La division cellulaire est à la base du développement et de la maintenance
d’un organisme vivant. Pour qu’une cellule en engendre deux, elle doit accomplir un
parcours complexe, composé de plusieurs phases caractérisées par des événements
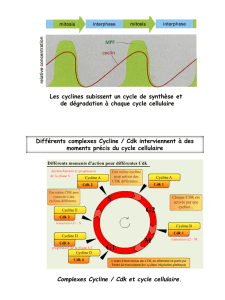
cellulaires distincts : les phases G1, S, G2 et M (figure 2) qui constituent le cycle
cellulaire.
Nous allons ici nous intéresser plus particulièrement à la phase S du cycle
cellulaire qui est caractérisée principalement par la réplication semi-conservatrice de
l’ADN. Cette phase fait suite à la phase G1. La transition de la phase G1 à la phase S
est principalement contrôlée par le complexe Cdk2/cycline E : l’expression de la

3
cycline E est périodique et maximale lors de la transition de la phase G1 à S. Elle
peut alors former un complexe actif avec son partenaire Cdk2 pour exercer son
activité régulatrice positive qui va favoriser la transition G1/S. En fin de phase G1, la
synthèse de la cycline A débute, elle peut alors à son tour former un complexe avec
Cdk2. Le complexe Cdk2/cycline A va réguler la progression de la cellule dans la
phase S (figure 2) via la phosphorylation de la protéine Rb (régulation positive) ou
des facteurs de transcription de la famille E2F qui sous leur forme non phosphorylée
vont pouvoir se lier à l’ADN pour induire la transcription des gènes nécessaires à la
progression dans la phase S (régulation négative) [4•].
La protéine Rb (protéine supresseur de tumeur) forme naturellement un
complexe avec les facteurs de transcription de la famille E2F [5•]. Sa
phosphorylation durant la phase S par le complexe Cdk2/cycline A va induire un
changement conformationnel du complexe pRb-E2F entraînant sa dissociation. Les
facteurs de transcription E2F alors libre peuvent se lier à l’ADN pour induire la
transcription des gènes de la phase S. L’expression des gènes de la phase S
dépend donc du complexe Cdk2/cycline A qui suivant son substrat de
phosphorylation va induire ou non la progression de la cellule dans la phase S.
Dans la plupart des cellules cancéreuses, la protéine Rb est non fonctionnelle
ce qui entraîne une concentration anormalement élevée de E2F libre dans la cellule
menant finalement à un développement tumoral.
Des études récentes [6••] ont montré que l’inhibition du complexe
Cdk2/cycline A par complexation avec un peptide RLX (motif de liaison de la cycline
A aux facteurs de transcription E2F) dans des cellules cancéreuses (pRb non
fonctionnelle) conduit à une concentration intracellulaire de E2F libre et non
phosphorylé encore plus importante. De plus, les facteurs de transcription E2F
exercent un rétrocontrôle positif sur l’expression de leur propre gènes, ce qui mènent
finalement à une inhibition de la croissance des cellules cancéreuses en raison d’une
concentration de E2F libre et non phosphorylé trop importante et donc toxique.
Cependant, cette stratégie nécessite une concentration intracellulaire
importante et continue du peptide RLX en raison d’une compétition avec les sites de
liaison naturels de Cdk2. C’est pourquoi, nous choisissons de développer une
stratégie antitumorale qui vise à détruire le complexe cdk2/cycline A en utilisant la
voie ubiquitine/protéasome et non pas à l’inhiber par complexation avec un peptide.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%