La régulation de la prolifération cellulaire (2)

C 25, Pr BERGERAT Pauline BOIREAU
Cours du 21.10.2011 15h à 16h Elodie CASTILLE
Master Cancérologie
_______________________________________________________________________________
C 25 1/5
La régulation de la prolifération cellulaire (2)
F. Rôle de c-myc dans le contrôle de la prolifération
- C-myc, N-myc, L-myc sont des protos-oncogènes qu'on retrouve régulièrement mutés dans différents
cancers.
- C-myc est un gène précoce immédiat induit par les stimuli mitogènes et les facteurs de croissance (en
faveur du cycle cellulaire ).
- Le mécanisme de l’induction de son expression est mal connu : son promoteur contient des éléments de
réponse pour plus de 50 types de facteurs transcriptionnels.
- Il régule l'expression d'au moins 300 gènes.
- C’est un facteur de transcription actif sous forme d’un hétérodimère activateur avec son partenaire Max.
En revanche, lorsque Max est associé au facteur Mad, le complexe formé est represseur.
- Il agit comme un activateur faible de l'activité de transcription ( 2 à 5 fois plus active lorsqu'il est lié ).
- Il existe environ 3000 gènes comportant une ou plusieurs séquences de réponse ( E-box, CACGTG ) à c-
myc dans leur promoteur. Seuls 600 gènes environ possèdent des séquences de haute affinité pour c-myc.
- Il contrôle, via l'expression génique, des phénomènes liés aux :
- protéines ribosomiales
- biogénèse des ARN ribosomiaux, mARN et tARN
- contrôle de la traduction
- ligands et récepteurs
- transduction des signaux
- facteurs de transcription
- réparation de l’ADN
- métabolisme - enzymes
- gènes de structure...

C 25 2/5
et active ainsi la croissance et prolifération cellulaire, et inhibe la différenciation. Il peut également induire
l'apoptose si trop peu de signaux anti-apoptotiques sont produits par la cellule (suite à une activation de la
prolifération supérieure à ce que peut supporter la cellule).
- C-myc a une demie-vie courte, de 15 à 30 minutes ; il est obligatoirement exprimé dans les cellules en
cycle. Il est en revanche systématiquement absent dans les cellules quiescentes.
L'arrêt de son expression provoque la sortie du cycle cellulaire.
- Elle subit une phosphorylation stabilisatrice et donc activatrice par la voie des Ras/MEK qui active ERK. En
revanche, une seconde phosphorylation par GSK3 provoque son ubiquitination et sa dégradation. La
protéine Ras active une kinase PI3 qui inhibe l'action de GSK3.
- C-myc est surexprimé dans la majorité des cancers ; il est en effet fortement impliqué dans la régulation
de la prolifération cellulaire. Il active par exemple la transcription des protéines CDK4, des cycles D1, D2, A
et E, de p14... Et inhibe notamment celle de p15, p21 et p27.
G. Rôle des facteurs E2F dans le contrôle de l'entrée en cycle
– La famille des facteurs E2F correspond à des facteurs de transcription séquestrés par Rb si celui-ci
n'est pas phosphorylé. Ils interviennent dans l'entrée dans le cycle cellulaire et dans le déroulement de
celui-ci.
– C-myc induit la synthèse des CDK4/6, qui réalisent la phosphorylation de Rb ; celui-ci relargue alors
E2F qui peut accomplir son rôle.
– La famille des facteurs E2F contient au moins huit membres ( E2F1, 2, 3a/b, 4, 5, 6, 7 et 8 ). E2F5, 6
et 7 recrutent des complexes inhibiteurs de l'expression génique, tandis que E2F1, 2, 3 t 4 sont activateurs.
Ils sont représentés ici avec la pocket protéine ( RB, p107, p130 ) à laquelle ils se lient.
– Dans une cellule quiescente, le complexe cycline C/ CDK3 induit la présence des E2Fs
inhibiteurs : la cellule reste en G0.
– Pour permettre l'entrée en cycle, le complexe cycline D/ CDK4 phosphoryle Rb afin de
permettre aux E2Fs activatrices de lier l'ADN et d'induite la transcription des gènes nécessaires au
cycle cellulaire
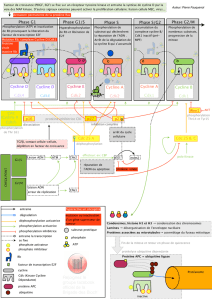
II. Les principaux acteurs de la régulation du cycle cellulaire
A. Cyclines, CDK ( Cyclines dependant kinases ) et complexes
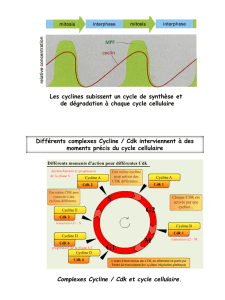
– Le déroulement du cycle cellulaire est régulé par l'activation successive de plusieurs protéines
kinases : cdk4, (cdk5), cdk6, cdk2, cdk3 , cdk7, cdk1 (cdc2). Leur taux est relativement constant au cours du
cycle. Elles ne sont actives que complexées à une cycline.

C 25 3/5
– L'expression des cyclines est variable au cours du cycle et spécifique de chaque phase du cycle :
cyclines D1, D2, D3, E, A, B1, B2, C.
– Des complexes cycline-cdk régulent le déroulement de chaque phase et le passage d'une phase à
l'autre :
. cyC/CDK3
–
–
–
B. Inhibiteurs des complexes cycline/CDK
–
–
–
–
–
S
cdk
4
M
od
e "
on
"
E
D
cdc
2
M
G
2
cdk
2
A
B
G
1

C 25 4/5
– La protéine p27 est fortement exprimée dans les cellules quiescentes. Tant qu'elle est exprimée et
active, l'entrée en cycle cellulaire est impossible. Elle est dégradée après sa phosphorylation par la cycline E.
Son expression est régulée positivement par PTEN, et négativement par c-myc et PI3-K.
– La protéine p21 est faiblement induite par le TGF bêta, mais très fortement par les dommages les
dommages de l'ADN ( via p53 ).
– Le TGF bêta régule positivement la transcription de p15 et p21, et négativement celle de CDK4. Elle
permet ainsi l'inhibition de CDK4 par p15, la libération de p27 séquestrée par la cycline D, l'inhibition de
E/CDK2 par p21 et p27 et finalement l'inhibition de l'entrée en phase S.
– C-myc diminue l'expression de p21 et de p27, ainsi que celle de p15. Il favorise ainsi la prolifération
cellulaire.
C. Rb et facteurs E2F
– Le complexe transcriptionnel DP-E2 F est un activateur de la transcription de gènes nécessaires à la
synthèse de l'ADN et permet ainsi le passage et l'exécution de la phase S. L'un des mécanismes d'action de
Rb est de se lier au complexe DP- E2F et de bloquer son activité. La phosphorylation de Rb par les CDK4-6
est donc importante pour permettre la poursuite du cycle.
– Certains virus, tels que SV40, l'adénovirus et le papillomavirus, produisent des facteurs protéiques
qui inactivent Rb et favorisent la transcription et la prolifération cellulaire incontrôlée.
III. Déroulement du cycle cellulaire
A. Phase G1
– Elle démarre par la dérépression des promoteurs réactifs à E2F1-2-3, réprimés jusque-là par p130-
E2F4.
– On a ensuite une accumulation progressive de cycline D, qui forme des complexes avec CDK4-6. Ces
complexes permettent une phosphorylation progressive de Rb.
– Il advient ensuite un début d’activation de promoteurs réactifs à E2F ; en fin de G1, ceux-ci
permettent la synthèse de régulateurs du cycle cellulaire ( E2F1, E2F2, cycline E, cycline A, cdk1... ).
– Il y a ensuite synthèse d’enzymes du métabolisme de l’ADN, et synthèse d’effecteurs et régulateurs
de la réplication (ADN polymérase alpha... )
B. Transition G1-S
– L'accumulation de la cycline D permet la séquestration de p27 par le complexe cycline D/CDK4-6.
Ces complexes sont alors activés. Il s'ensuit l'expression de la cycline E et la formation de complexes cycline
E/CDK2.
– Il advient ensuite la phosphorylation, l'ubiquitination et dégradation brutale de p27, conjointement
à une activation maximale des complexes cycline/CDK, et à la phosphorylation de Rb. Cette inactivation de
Rb constitue le point central de cette transition, le point de contrôle qui va permettre le basculement total
en phase S.
– Parallèlement, la libération complète des facteurs E2F induit l'activation transcriptionnelle

C 25 5/5
maximale des acteurs du métabolisme des nucléotides et de la réplication de l’ADN, avec un assemblage et
une activation des complexes de pré-replication ; une phosphorylation de NPAT et une synthèse des
histones ; la phosphorylation de la nucléophosmine et la duplication des centrosomes.
– Tout est ainsi en place pour permettre la réplication de l'ADN lors de la phase S.
C. Phases S et G2
– L'expression de la cycline A se fait pendant les phases S et G2, ce qui permet l'activation des
complexes cycline A/CDK2.
– Ces complexes réalisent la régulation de l’activité transcriptionnelle (E2F...), des phosphorylations et
donc la régulation de l’activité des acteurs de la réplication de l’ADN (ADN pol alpha, facteurs de réplication
de l’ADN), et des protéines de maintenance de l’ADN. Ils réalisent également le contrôle de l’intégrité du
génome (phase G2), la détection de l’ADN simple brin et la régulation de l’activité des enzymes de
réparation.
– Ces phases voient également l'accumulation de cycline B sous forme de complexes cycline B/CDK1,
cytoplasmiques et inactifs.
D. Transition G2- mitose
– Elle est contrôlée par l'activation du complexe cycline B/CDK1 par des phosphorylations activatrices
qui permettent sa translocation nucléaire ( depuis sa localisation cytoplasmique lors de la phase G2 ).
– Ce complexe agit sur un grand nombre de cibles :
. condensation des chromosomes ( histone H1, topoisomérase II )
. disparition de la membrane nucléaire ( laminines, nucléolines )
. réorganisation des microtubules ( MAP )
. réarrangment du cytosquelette ( viementine, caldesmosine, myosine )
. facteurs transcriptionels
. phosphorylation de protéines kinases et d'oncogènes
et rend ainsi possible la réalisation de la mitose.
E. Régulation de la mitose
– La prophase se caractérise par la régulation de la condensation des chromosomes, la régulation de
la maturation des centrosomes et la régulation de l’assemblage du fuseau mitotique.
– En métaphase a lieu la régulation de l’alignement des chromosomes.
– L'anaphase voit la régulation de la ségrégation des chromosomes : APC, Mad2 et check point du
fuseau mitotique ( cf exemple ci-dessous ).
– Enfin lors de la télophase et de la cytocinèse ont lieu la migration polaire des chromosomes et le
désassemblage du fuseau mitotique.
– Exemple de régulation : l'alignement des chromosomes. Tant que les kinétochores ne sont pas
correctement fixés et équilibrés, les deux chromosomes pairs sont rattachés par une molécule appelée
cohesine. Lorsque la scission peut se faire, la protéine Mad 2 dégrade la sécurine, qui inhibait la séparase ;
cette séparase peut alors scinder la cohésine et permettre la séparation des chromosomes.
1
/
5
100%