ENZYTEC fluid D-Glucose / D-Fructose Ref. n°: 5160

ENZYTECTM fluid D-Glucose / D-Fructose Ref. n°: 5160
Coffret pour 4 x 10 déterminations (pour usage in vitro uniquement) page 1 / 2
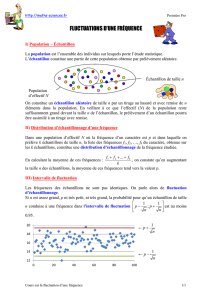
Réactif pour la mesure du D-Glucose par photométrie en UV, dans des échantillons alimentaires.
Méthode
Test enzymatique en UV utilisant l’Hexokinase (HK) et la Phosphoglucose-
isomérase (PGI).
Principe
D-Fructose + ATP HK > Fructose-6-phosphate + ADP
D-Glucose + ATP HK > Glucose-6-phosphate + ADP
Fructose-6-phosphate < PGI > Glucose-6-Phosphate
Glucose-6-phosphate + NAD+ G6P-DH > Gluconate-6-P + NADH + H+
Stockage et stabilité des réactifs
Les réactifs sont stables jusqu’à la fin du mois de la date de péremption
indiquée, à condition de les stocker entre 2 et 8 °C, et en évitant toute
contamination. Ne pas congeler les réactifs!
Avertissements et précautions
1. Les réactifs contiennent de l’azide de sodium (0,95 g/l) comme
conservateur. Ne pas avaler! Éviter tout contact avec la peau et les
membranes muqueuses.
2. Prendre les précautions nécessaires à l'utilisation de réactifs de
laboratoire.
Préparation des réactifs
Les réactifs ainsi que les standards sont prêts à l’emploi.
Matériel requis mais non fourni
Eau distillée (aseptique et sans métaux lourds) et équipement de laboratoire.
Contenu du coffret et concentration des réactifs
R1 4 x 20,8 ml Tampon pH 7,8
ATP 1,7 mmol/l
NAD 1,7 mmol/l
R2 4 x 5,5 ml Tampon pH 7,0
Hexokinase (HK) ≥ 1,5 kU/l
Glucose-6-phosphate
dehydrogenase (G6P-DH) ≥ 1,5 kU/l
R3 4 x 5,0 ml Tampon pH 7,8
Phoshoglucose Isomerase
(PGI) ≥ 20 KU/l
Préparation des échantillons (le cas échéant)
Si les échantillons présentent l’une ou l’autre des caractéristiques détaillées
ci-dessous, lesquelles perturbent le test, suivre les instructions
correspondantes.
• Utiliser des échantillons liquides clairs, transparents et pratiquement
neutres. Si nécessaire diluer l’échantillon pour obtenir une concentration
en D-Glucose et D-Fructose comprise entre 90 et 1000 mg/l.
• Filtrer ou centrifuger les solutions troubles.
• Eliminer le gaz carbonique contenu dans les échantillons.
• Ecraser ou homogénéiser les échantillons solides et semi-solides. Peser
une quantité suffisante d’échantillon (en fonction de la concentration) dans
une flasque volumétrique, extraire avec de l’eau. Filtrer, centrifuger ou
utiliser une clarification Carrez si nécessaire.
• Pour les échantillons contenant des matières grasses, peser une quantité
suffisante d’échantillon (en fonction de la concentration) dans une flasque
volumétrique, extraire avec de l’eau chaude. Refroidir pour permettre la
séparation des graisses, en plaçant la flasque dans un bac de glace
pendant 15 minutes et filtrer. On peut aussi clarifier avec les réactifs de
Carrez après l’extraction.
• Ajuster les échantillons acides en ajoutant du NaOH (ou KOH), les
échantillons alcalins en ajoutant du HCl, jusqu’à obtenir un pH 8 env.
Laisser reposer pendant env. 15 min.
• Traiter les échantillons très colorés avec du Polyvinyl Polypyrolidon
(PVPP, par exemple 1g/100ml d’échantillon), ou mesurer chaque
échantillon avec un blanc échantillon au lieu d’un blanc réactif (si
nécessaire ajuster à pH 8), en se reportant au mode opératoire.
• Clarification de Carrez : suivre le protocole habituel de la réaction de
Carrez.
Mode opératoire
Longueur d’onde: 340 nm, Hg 334 nm, Hg 365 nm
Cuvette de mesure: 1 cm
Température: 20 – 25°C / 37°C
Mesure: contre l’air ou l‘eau
Blanc
réactif (BR) Échantillon Blanc
échantillon
(BE, facultatif)
Échantillon/ standard - 100 µl
100 µl
Eau distillée 100 µl - -
Réactif 1 2000 µl 2000 µl 2000 µl
Mélanger, incuber pendant 1 min. à 37 °C ou 3 min. à 20 – 25 °C, lire
l’absorbance A1, et rajouter :
Réactif 2 500 µl 500 µl -
Eau distillée - -
500 µl
Mélanger, attendre la fin de la réaction (incubation d’environ 10 min. à
37°C ou 15 min. à 20 - 25°C), lire l’absorbance A2 et ajouter :
Réactif 3 500 µl 500 µl -
Eau distillée - -
500 µl
Mélanger, attendre la fin de la réaction (incubation d’environ 10 min. à
37°C ou 15 min. à 20 - 25°C), lire l’absorbance A3.
Des fiches techniques pour automates de chimie sont disponibles sur
demande.
Calcul des résultats
Glucose
Mesure avec blanc réactif (BR):
∆A = (A2 – fd x A1)échantillon – (A2 – fd x A1)BR
Mesure avec un blanc échantillon (BE):
∆A = (A2 – fd x A1)échantillon – (A2 – fd x A1)BE
Avec fd = facteur de dilution de la densité optique, du fait des volumes de
réactifs rajoutés pendant le test :
fd = (volume échantillon + R1) / (volume échantillon + R1 + R2) = 0,808.
Formule de calcul:
CD-glucose [g/l d’échantillon] = V x MW x ∆A
ε x d x v x 1000
avec:
V (volume total) = 2600 [µl]
MW (masse moléculaire) = 180,16 [g/mol]
d (cuvette de mesure) = 1,00 [cm]
v (volume d’échantillon) = 100 [µl]
ε (coefficient d’absorption du NADH) [l x mmol-1 x cm-1]
340 nm = 6,3 334 nm = 6,18 365 nm = 3,4
Il en résulte pour les différentes longueurs d’onde:
340 nm: c D-Glucose [g/l] = 0,744 x ∆A
334 nm = 0,758 x ∆A
365 nm = 1,378 x ∆A
Fructose
Mesure avec blanc réactif (BR):
∆A = (A3 – fd x A2)échantillon – (A3 – fd x A2)BR
Mesure avec un blanc échantillon (BE):
∆A = (A3 – fd x A2)échantillon – (A3 – fd x A2)BE
Avec fd = facteur de dilution de la densité optique, du fait des volumes de
réactifs rajoutés pendant le test :
fd = (volume échant. + R1 + R2) / (volume échant. + R1 + R2 + R3) = 0,839.
Formule de calcul:
CD-glucose [g/l d’échantillon] = V x MW x ∆A
ε x d x v x 1000
avec:
V (volume total) = 3100 [µl]
MW (masse moléculaire) = 180,16 [g/mol]
Il en résulte pour les différentes longueurs d’onde:
340 nm: c D-Glucose [g/l] = 0,887 x ∆A
334 nm = 0,904 x ∆A
365 nm = 1,643 x ∆A
Les formules doivent être recalculées lorsqu’un paramètre est modifié, par
ex. le volume de l’échantillon.
Si l’échantillon a été dilué, multiplier la concentration trouvée par le facteur
de dilution.

ENZYTECTM fluid D-Glucose / D-Fructose Ref. n°: 5160
page 2 / 2
Échantillons solides:
Contenu D-glucose [g/100 g] = c D-glucose [g/l ] x 100
poids échantillon [g/l solution]
Contenu D-fructose [g/100 g] = c D-fructose [g/l ] x 100
poids échantillon [g/l solution]
Mode opératoire pour la détermination du Glucose + Fructose
sans différentiation (sucres totaux)
Des fiches techniques pour automates de chimie sont disponibles sur
demande.
Longueur d’onde: 340 nm, Hg 334 nm, Hg 365 nm
Cuvette de mesure: 1 cm
Température: 20 – 25°C / 37°C
Mesure: contre l’air ou l‘eau
Blanc
réactif (BR) Échantillon Blanc
échantillon
(BE, facultatif)
Échantillon/ standard - 100 µl
100 µl
Eau distillée 100 µl - -
Réactif 1 2000 µl 2000 µl 2000 µl
Mélanger, incuber pendant 1 min. à 37 °C ou 3 min. à 20 – 25 °C, lire
l’absorbance A1, et rajouter :
Réactif 2 500 µl 500 µl -
Réactif 3 500 µl 500 µl -
Eau distillée - -
500 µl
Mélanger, attendre la fin de la réaction (incubation d’environ 10 min. à
37°C ou 15 min. à 20 - 25°C), lire l’absorbance A2.
Note:
R2 et R3 peuvent être pré-mélangés. Mélanger 1 volume de R2 avec 1
volume de R3 (par ex. : 5 ml R1 + 5 ml R2) et utiliser 1000 µl du mélange
pour la détermination.
La stabilité du mélange est d’une semaine entre 2 et 8°C. Ce mélange de
réactifs doit être protégé de la lumière!
Calcul des résultats
Glucose + Fructose sans différentiation (sucres totaux)
Mesure avec blanc réactif (BR):
∆A = (A2 – fd x A1)échantillon – (A2 – fd x A1)BR
Mesure avec un blanc échantillon (BE):
∆A = (A2 – fd x A1)échantillon – (A2 – fd x A1)BE
Avec fd = facteur de dilution de la densité optique, du fait des volumes de
réactifs rajoutés pendant le test :
fd = (volume échant. + R1) / (volume échant. + R1 + R2 + R3) = 0,677.
Formule de calcul:
C sucres totaux [g/l d’échantillon] = V x MW x ∆A
ε x d x v x 1000
avec:
V (volume total) = 3100 [µl]
MW (masse moléculaire) = 180,16 [g/mol]
d (cuvette de mesure) = 1,00 [cm]
v (volume d’échantillon) = 100 [µl]
ε (coefficient d’absorption du NADH) [l x mmol-1 x cm-1]
340 nm = 6,3 334 nm = 6,18 365 nm = 3,4
Il en résulte pour les différentes longueurs d’onde:
340 nm: c sucres totaux [g/l] = 0,887 x ∆A
334 nm = 0,904 x ∆A
365 nm = 1,643 x ∆A
Calibration / contrôle de qualité
Pour calibrer le test sur des automates de biochimie, ou pour contrôler la
qualité des résultats en utilisation manuelle, utiliser le kit Enzytec Fluid
Sugar combination standard (Cat. No. 5440, 3 x 3 ml). Le standard est prêt à
l’emploi.
Performances
Domaine de mesure
Le test a été développé pour déterminer la concentration en D-Glucose et
D-Fructose dans un domaine de mesure compris entre 20 et 1000 mg/l
(mesure à 340 nm). Lorsque les valeurs dépassent le domaine de mesure,
les échantillons doivent être dilués avec de l’eau distillée dans un fourchette
de 90 à 1000 mg/l. Multiplier le résultat obtenu par le facteur de dilution.
Spécificité
La détermination est spécifique pour le D-Glucose et le D-Fructose. Si le
ratio D-Glucose/D-Fructose est supérieur à 10 :1, la précision de la mesure
du D-fructose diminue.
Limite inférieure de détection
4,8 mg/l, mesurés à 340 nm.
La limite inférieure de détection correspond à la plus petite concentration
statistiquement différente de la concentration zéro. Elle est calculée à partir
de trois écarts types d’un échantillon zéro (sans D-glucose ni D-fructose)
mesuré 20 fois de suite.
Gestion des déchets
Suivre les recommandations légales en vigueur
v23.06.2007
1
/
2
100%