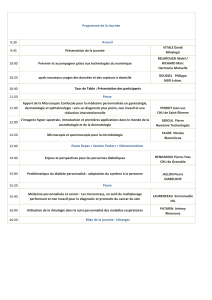
Nanocristaux semiconducteurs fluorescents ou

1
Les traceurs
1- Les traceurs fluorescents
Certaines molécules organiques absorbent la lumière à certaines longueurs d'onde ; elles réémettent
pendant un temps 1res court (10- 16s) une lumière de plus grande longueur d'onde.
principe de la fluorescence :
Un photon provenant d'une source lumineuse (laser, lampe à vapeur de mercure, etc.) provoque le
passage I d'un électron d'une orbite stable à une orbite instable. Pendant cet état instable (qui dure
de l'ordre de l quelques nanosecondes) l'électron perd de l'énergie par interaction avec
l'environnent. Il retourne à son orbite stable en émettant un photon d'énergie plus faible que le
photon d'excitation et donc de longueur d'onde plus élevée. Le décalage entre les longueurs d’onde
d'excitation et d'émission est appelée "décalage de Stokes" (en
anglais "Stoke's shift").

2
Nanocristaux semiconducteurs fluorescents ou "Quantum dots"

3
Leurs propriétés remarquables :
Le cœur des QD est généralement contenu dans une coque protectrice, par exemple du sulphite de
zinc. Pour des applications en immunohistochimie cette coque hydrophobe est entourée de
molécules hydrophiles permettant la fixation des ligands, streptavidine, anticorps, etc. (Goldman et
coll. 2002) .

4
Avantages
inconvénients
Sa fabrication (l’or colloïdal) est extrêmement simple et bon
marché.
Les conjugués peuvent présenter un
excès de charges négatives : les billes
d'or peuvent alors donner des
marquages non spécifiques en se
fixant sur les groupements
cationiques présents dans les tissus.
Il peut être obtenu en différentes tailles, entre 1 a 100 nm
environ (Horisberger, 1981; Mulpfordt, 1982).
Pratiquement inutilisables en
marquage pré-inclusion pour les
tailles supérieures à 2-3 nm de
diamètre.
*Les billes de grandes tailles sont utilisées en microscopie à
balayage
*les billes de taille moyenne (10-20 nm) sont adaptées aux
marquages de cellules (cellules endocrines par exemple)
*enfin les plus petites tailles (au-dessous de 10nm) sont
utiles pour les marquages fins (localisation d'antigènes
membranaires, d'histones ou de séquences nucléotidiques
sur des chromosomes par exemple).
l'or colloïdal peut être utilisé aussi bien en microscopie
électronique qu'optique (2nm et au-dessous).
La réaction peut être intensifiée à l'argent :
*en microscopie optique la sensibilité est alors tout a fait
semblable a celle des traceurs enzymatiques ;
*en microscopie électronique, l'intensification permet de
visualiser les billes dont le diamètre est faible (< 3 nm) (car
elle augmente la taille des billes).

5
La lumière, généralement émise par un laser (et dans ce cas monochromatique), est
réfléchie par un miroir dichroïque vers la lentille objectif. L'objectif focalise le faisceau sur
l'échantillon en un « spot » dont la taille peut être réduite à un diamètre de 0,25 μm dans
un plan horizontal et 0,5 μm en profondeur. Un système de balayage (non représenté)
assure un déplacement du spot dans le plan horizontal et parfois vertical. La fluorescence
émise par l'élément éclairé retourne à travers l'objectif, traverse le miroir dichroïque et un
système (non représenté) de sélection de la bande de longueur d’onde à observer avant
d’atteindre le détecteur. Devant le détecteur, un diaphragme de très petite ouverture
(pinhole) ne laisse passer que la lumière émise par les éléments fluorescents présents
dans le plan focal : une grande partie de la fluorescence en provenance de plans situés au
dessus ou au dessous du plan focal (rayons lumineux représentés en pointillés) est
éliminée grâce au diaphragme du détecteur. La source lumineuse, le détecteur et le spot
éclairant l'échantillon sont dans le même plan focal, d'où l'appellation « microscope
confocal ».
 6
6
 7
7
 8
8
1
/
8
100%