Les amines - Pages Persos Chez.com

L
L
Le
e
es
s
sa
a
am
m
mi
iin
n
ne
e
es
s
s
I
I_
_I
In
nt
tr
ro
od
du
uc
ct
ti
io
on
n
A
A.
.L
Le
es
sd
di
if
ff
fé
ér
re
en
nt
te
es
sa
am
mi
in
ne
es
s
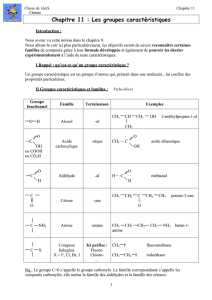
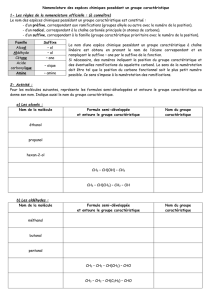
lClasses des amines :
lTypes des amines :
B
B.
.N
No
om
me
en
nc
cl
la
at
tu
ur
re
e
Ex :
C
C.
.P
Pr
ro
op
pr
ri
ié
ét
té
és
sp
ph
hy
ys
si
ic
co
o-
-c
ch
hi
im
mi
iq
qu
ue
es
s
Les amines possèdent une odeur forte, une odeur de poisson.
lStabilité :
R—NH2
N—H
R
R
R
R
R
N
R
R
R
NR
Amines
primaires Amines
secondaires Amines
tertiaires Ammoniums
quaternaires
R—NH2
Amines
acycliques Amines
alicycliques Amines
aromatiques Amines
hétérocycliques
NH2NH2
N N
H
Pyridine
Pipéridine
NGroupements
attachés au NChaîne la plus
longue amine
N
H
1
2
3
N-méthyl-2-
méthylpropylamine
Create PDF with GO2PDF for free, if you wish to remove this line, click here to buy Virtual PDF Printer

Les amines peuvent former des liaison hydrogènes, bien que Nsoit moins
électrostatiques que O. La polarité d'une amine est donc plus faible que celle d'un
alcool. Leur température d'ébullition est autour de 20°C, ainsi les amines sont la
plupart du temps sous forme gazeuse.
lStructure :
hCes remarques ne sont pas valables pour les ammoniums !
lSpectroscopie :
Type d'amine Bandes d'absorption
Amines primaires Doublet de bandes entre –3500 et –3400 cm-1
Amines secondaires Simple bande entre –3400 et –3300 cm-1
Amines tertiaires Pas de bandes dans ces fréquences
lPropriétés acido-basiques :
En solution aqueuse :
Composé Ph—NH2NH3CH3—NH2(CH3)2NH(CH3)3N
pKA4,6 9,2 10,6 10,7 9,8
À part la phénylamine qui est stabilisée par résonance, l'ordre de basicité est
difficile à démontrer. On retient que les amines sont généralement basiques, et que
leurs acides conjugués sont des acides très faibles (pKA> 30) ; les amines sont donc
difficilement protonnables.
lSynthèse du LDA :
Le LDA est une base extrêmement puissante, qui peut transformer les alcanes
en carbanions sur le carbone Ñ.
I
II
I_
_R
Ré
éa
ac
ct
ti
iv
vi
it
té
é
A
A.
.A
Al
lk
ky
yl
la
at
ti
io
on
n
N
N
àLa structure de l'amine est très flexible,
l'interconversion est très facile et très rapide (30
kJ.mol-1).
àUne amine se retourne à peu près 1000 fois
par seconde ! C'est l'effet parapluie. Il n'y a donc
pas de chiralité au niveau des amines.
NH+Bu—Li N+Li +Bu—H
Create PDF with GO2PDF for free, if you wish to remove this line, click here to buy Virtual PDF Printer

NH2CH3—I N
CH3
CH3
CH3I
La méthode qui précède est la plus mauvaise méthode d'alkylation. Il faut
rajouter une base afin d'éviter au Nd'attaquer un H+. De plus, RNHR' réagit encore
deux fois avec R'—X( on dit qu'il y a polyalkylation sur l'azote ).
àSolutions :_ Mettre l'amine en fort excès ( très mauvaise méthode )
_ Utiliser de l'halogénure d'alkyle en excès ( formation de sels
d'ammoniums ), c'est la réaction d'Hoffmann.
_ Autre méthode d'alkylation directe
Remarque : chez les amines tertiaires, seule l'élimination est possible.
lMéthodes de synthèse d'amines par alkylation indirecte :
a) Amination d'un dérivé carbonylé, puis réduction
Remarques :_ On peut fabriquer des amines secondaires à partir d'amines primaires
et des amines tertiaires à partir d'amines secondaires
_ On peut utiliser NaBH4à la place du palladium sur charbon. C'est un
hydrure très puissant, il est impossible de l'utiliser dans un milieu acide
( dégagement immédiat de H2 ) èUtiliser NaBH3CN.
R—NH2+R'—XRNR'
H
H
+XRNR'
H
+H—X
CH
H
CH2Br +Et3NECHCH2BrEt3NH
+ +
CH2
H
CH2Br
SN2
NEt3+
O+R—NH2
N
R
H H
O OH
N
RH
N
R
HOHNR
+H2O
Imine
H2
Pd / C
NR
H
Create PDF with GO2PDF for free, if you wish to remove this line, click here to buy Virtual PDF Printer

b) Réaction d'Eischweiler-Clark
àC'est une excellente méthode d'alkylation des amines primaires et secondaires
Ex :
c) Synthèse de Gabriel
àC'est une très bonne méthode de synthèse d'amines primaires
R—NH2
Formol
Acide
formique
CO
H
H
CH
O
OH
R—NH—CH3
N
H
CO
H
H
H+N
HCH2
OH
N
CH2OH
H
N
CH2O
H
H
N
CH2
H
N
CH3
CH
O
O
CO2
O
O
NKR—X
O
O
NRH+/H2O
OH+/H2O
O
O
R—NH3
OH
OH+NaOH
*
R—NH2
Phtalmide
Create PDF with GO2PDF for free, if you wish to remove this line, click here to buy Virtual PDF Printer

d) Méthodes indirectes
àRéaction de type SN puis libération d'amine
Remarque : LiAlH4est un hydrure encore plus réactif que NaBH4.
lRéduction de NO2:
lBlocage du doublet de l'azote :
B
B.
.R
Ré
éa
ac
ct
ti
io
on
nd
d'
'é
él
li
im
mi
in
na
at
ti
io
on
nd
d'
'H
Ho
of
ff
fm
ma
an
nn
n
Si le groupement ammonium est lié et si le carbone Òest substitué par un
atome d'hydrogène, une réaction d'élimination est possible.
àLe mécanisme est une E2à caractère E1SB :
R—X+Na +CNR—C—N|
Nitrile
H2Pd/C
ou
LiAlH4
R—CH2—NH2
R—X+Na +N3R—N3H2Pd/C
ou
LiAlH4
R—NH2+N2
R—NO2LiAlH4
ou
Fe / HCl
ou
Zn / CH3COOH
ou
H2/ catalyseur
R—NH2
RN
H
H+CH3C
O
Cl
RN
H
C
O
CH3
RN
H
C
O
CH3
Nu
RNC
O
CH3
CH3—I
RNC
O
CH3
CH3
H+/H2O
C C
NR3
H
OH
C C
NR3
Create PDF with GO2PDF for free, if you wish to remove this line, click here to buy Virtual PDF Printer
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%