Produits ménagers : Acides ou bases ? Activité de chimie
Telechargé par
Halfaoui Samir

1
Thème du programme
Sous-thèmes
Chimie et développement durable
Analyses physico-chimiques
Préparation de solutions
Dosage par titrage
Titre
Produits d’entretien ménagers
Acides ou basiques ?
Type d’activité
Travail en autonomie par groupes avec activité expérimentale
Conditions
de mise en
oeuvre
durée
Partie 1 :1h 30 Partie 2 : 2h 00
Pré -
requis
Solutions acides et basiques en classe de 3°
Pictogrammes SGH de sécurité
Connaissance de la verrerie
Concentrations massique et molaire (1ère)
Réactions acide-base et transferts de protons. (Tronc
commun de terminale)
Partie concernée du programme
Notions et contenus
Capacités exigibles
Titrage avec indicateurs colorés
Solvant : eau distillée, eau permutée.
- soluté : densité, titre massique, concentrations
massique et molaire.
Indicateur coloré acido-basique ; zone de virage.
Choix d'un indicateur pour un titrage donné.
Indicateur coloré de précipitation.
-Tronc commun. Citer des produits
d'entretien couramment utilisés dans l'habitat
(détartrants, déboucheurs, savons, détergents,
désinfectants, dégraissants, etc.) ; reconnaître
leur nature chimique et leur précaution
d'utilisation (étiquette, pictogramme).
- SPCL Préparer une solution aqueuse de
concentration donnée à partir d'un solide
- Proposer et réaliser un protocole de titrage
mettant en œuvre un indicateur coloré.
Repérer expérimentalement l'équivalence.
-Justifier le choix d'un indicateur coloré pour
un titrage donné à partir de la courbe de
titrage pHmétrique.
Compétences transversales
- Rechercher, extraire et organiser l’information utile provenant
d’un document, d’une situation ou d’une expérience.
- Faire preuve d’initiative, d’esprit critique.
- Proposer un protocole expérimental, à mettre en œuvre en
respectant les règles de sécurité.
- Travailler en groupe.
Mots clés de recherche
Dissolution, titrage, acido-basicité, indicateur coloré, pH.
Auteurs
Emmanuel RIGOLET
Lycée Louis Armand.
Chambéry (73)
Sciences physiques.
Académie de Grenoble

2
Partie 1. Produits ménagers : Acides ou bases ?
A. Exploitation de documents :
Document 1
http://www.danger-sante.org/produit-menager-entretien-nettoyant Les produits ménager sont très nombreux : décape-
four, poudres de lavage pour lave-vaisselle, antirouille, détartrants, eau de javel concentrée, spray
vitres, bombe anti-poussière…
Pour vos enfants, ne stockez jamais les produits ménagers sous l’évier, dans les toilettes ou dans la
salle de bains.
Ils doivent être hors de portée des enfants.
Ne transvasez jamais un produit dangereux dans un contenant alimentaire tel qu’une bouteille en verre,
bouteille d’eau minérale ou de jus de fruit.
Les produits ménagers pour la vaisselle
Détergent composé principalement d’agents nettoyants appelés tensioactifs et d’autres ingrédients
comme des colorants, conservateurs, parfum de synthèse…
Les antibactériens sont à éviter absolument. D’abord parce qu’ils ne servent à rien : ils n’éliminent
qu’une partie des bactéries, les bactéries restantes ne mettent que quelques instants à se multiplier pour
être aussi nombreuses qu’au départ.
De plus il est inutile de chercher à désinfecter la vaisselle (par exemple à l’eau de Javel) pour l’essuyer
ensuite avec un torchon qui n’est pas stérile.
L’autre inconvénient des agents antibactériens est qu’ils favorisent des bactéries plus résistantes.
Les dangers pour la santé des produits vaisselle :
Certaines personnes sont sensibles aux détergents. En effet, ils agissent sur la peau comme sur la
vaisselle, ils la dégraissent en lui enlevant sa protection naturelle. Dessèchement, crevasses, allergies
sont le revers des vaisselles à la main quotidiennes : pensez à porter des gants !
Les produits ménagers détergents pour lave-vaisselle
Les poudres, gels et liquides sont des caustiques puissants. C’est l’une des catégories de produits dans
lesquelles on retrouve la plus grande proportion de phosphates. Les phosphates augmentent l’efficacité
du lavage en adoucissant l’eau, en mettant la saleté en suspension et surtout, en rendant l’huile et la
graisse solubles dans l’eau.
Les dangers pour la santé des détergents pour le lave-vaisselle :
Projetés dans l’œil ou sur la peau, ils provoquent une brûlure sévère et immédiate. Avalés, même en
petites quantités, ils brûlent la bouche, la gorge et le tube digestif. Ces brûlures sont graves et laissent
souvent des séquelles digestives même après traitement.

3
Les produits ménagers de nettoyage pour le four
Soude caustique, carbonate ou hydroxyde de sodium ou de potassium…
Les dangers pour la santé des produits de nettoyage pour four :
Une utilisation imprudente de ces produits peut causer de graves problèmes aux yeux et à la peau,
surtout des brûlures. L’inhalation peut provoquer des irritations des muqueuses du nez et des voies
respiratoires. L’ingestion cause des brûlures dans tout le système digestif et peut être mortelle. Ces
produits sont souvent présentés en aérosols, un conditionnement qui augmente les risques lors de
l’utilisation : ils propulsent de fines gouttelettes qui restent en suspension dans l’air et peuvent être
facilement inhalée ou venir en contact avec la peau et les yeux
Les produits ménagers nettoyants pour les sols
Ils contiennent parfois du LAS (linear-alkylbenzène-sulfonate), un tensioactif pétrochimique.
Les dangers pour la santé des nettoyants pour le sol :
Risque d’irritations ou d’allergies respiratoires (pollution de l’air intérieur).
Les produits ménagers nettoyants pour salle de bains
A base de tensioactifs, d’acides (chlorhydrique, sulfurique, phosphorique) et d’additifs (épaississants,
parfums et colorants).
Les dangers pour la santé des nettoyants de salle de bains : Des risques de brûlures, irritations
des voies respiratoires, des yeux et des muqueuses.
Les produits ménagers gel liquide WC
Généralement composés d’agents tensioactifs (détergents), d’acides (chlorhydrique, sulfurique,
phosphorique) pour dissoudre le tartre, d’additifs pour leur donner de l’épaisseur, de la couleur et du
parfum. On leur rajoute souvent des désinfectants.
Les dangers pour la santé des gel liquide pour WC :
Risque de brûlures, irritations des voies respiratoires, des yeux et des muqueuses.
Les produits ménagers déboucheurs de canalisation
Soude caustique, carbonate ou hydroxyde de sodium ou de potassium… et parfois même acide
sulfurique.
Les dangers pour la santé des déboucheurs de canalisation pour la maison :
Ce produit est corrosif et agressif, il peut causer des brûlures et de graves lésions aux yeux.
Les produits ménagers lave-vitre
Très peu d’information sur la composition mais souvent une liste interminables de produits qui
comprend de l’ammoniac et de l’alcool.
Les dangers pour la santé des lave vitre : Dangereux si votre produit contient de l’ammoniaque.
Les produits ménagers avec de l’eau de javel
Hypochlorite (dérivé du chlore de sodium).
Les dangers pour la santé de l’eau de javel :
Utilisée en mélange avec des produits d’entretien contenant de l’acide (détartrant, nettoyant
pour sanitaires, antirouille…), un dégagement gazeux survient et peut provoquer des effets tels
que l’irritation des muqueuses et des yeux, des maux de tête, des nausées… Cela peut aller
jusqu’au développement d’un œdème pulmonaire avec risque de complications infectieuses. Si
l’eau de Javel entre en contact avec de l’ammoniaque, c’est un gaz plus dangereux encore qui
se forme et qui peut provoquer des dommages importants aux poumons.

4
Document 2.
Exploitation des documents 1 et 2.
1. Compléter la fiche « pictogrammes » à partir de vos connaissances ou d’une recherche documentaire
(livre, CDI, internet…)
2. Vous disposez d’un produit de nettoyage d’usage courant. En consultant son étiquette, élaborer sa fiche
de danger.
Symbole
Signification
Description des risques
T
……………..
T+
…………………
Produits qui, par inhalation, ingestion ou pénétration cutanée en petites quantités,
entraînent la mort ou des effets aigus ou chroniques.
Xn
………………..
Xi
………………
- Produits qui, par inhalation, ingestion ou pénétration cutanée en petites quantités,
peuvent éventuellement entraîner la mort ou des effets aigus ou chroniques.
- Produits non corrosifs qui en cas de contact ou d'inhalation peuvent provoquer une
irritation de la peau et des voies respiratoires, une inflammation des yeux.
C
………………
Produits pouvant exercer une action destructive sur les tissus vivants.
F ………………
inflammable
F+ ……………
inflammable
Produits pouvant s'enflammer facilement en présence d'une source d'inflammation à
température ambiante (< 21°C).
Produits pouvant s'enflammer très facilement en présence d'une source d'inflammation
même en dessous de 0°C.
O
…………………..
Produits pouvant favoriser ou activer la combustion d'une substance combustible. Au
contact de matériaux d'emballage (papier, carton, bois) ou d'autres substances
combustibles, ils peuvent provoquer un incendie.
E
…………………
Ce sont des liquides ou des solides capables d'exploser sous l'action d'un choc, d'un
frottement, d'une flamme ou de chaleur.
N
Dangereux pour
…………………..
Produits qui peuvent présenter un risque immédiat ou différé pour une ou plusieurs
composantes de l'environnement (c'est à dire capables, par exemple de causer des
dommages à la faune, à la flore ou de provoquer une pollution des eaux naturelles et de
l'air).

5
B. Activité expérimentale et exploitation.
Vous disposez de chacun des produits mentionnés dans le document 1.
1. Rédiger un protocole expérimental pour les classer du plus acide au plus basique.
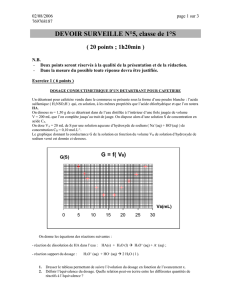
2. Après avoir mis en œuvre votre protocole, construire une échelle de pH de 0 à 14 sur laquelle vous
placerez les produits utilisés.
3. Sachant que pH = -log [H3O+] ,dire comment évolue [H3O+] du produit le plus acide au produit le plus
basique .
4. Ecrire la formule de l’acide conjugué de l’eau H2O. En déduire le couple acido-basique correspondant
et sa demi-équation protonique. Citer un produit ménager dans lequel on peut retrouver ce couple
acide/base.
5. Ecrire la formule de la base conjuguée de l’eau. En déduire le couple acido-basique correspondant et sa
demi-équation protonique. Citer un produit ménager dans lequel on peut retrouver ce couple acide/base.
6. Quelle remarque pouvez-vous faire concernant l’eau ?
Aide 1 :
Un acide est une espèce chimique capable de libérer un proton H+
Une base est une espèce chimique capable de capter un proton H+
A tout acide de type HA est associé une base conjuguée de type A-. HA/A- constitue un couple acido-
basique d’équation protonique : HA = H++A-
A tout acide de type BH+ est associé une base conjuguée de type B. BH+/B constitue un couple acido-
basique d’équation protonique BH+ = H++B
 6
6
 7
7
 8
8
 9
9
1
/
9
100%