SAINTS CŒURS Classe de TS - studynet-lb

Acides au quotidien
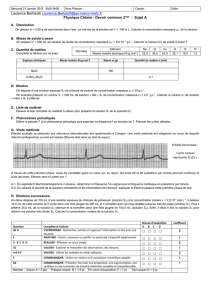
Les détartrants pour cafetières présents sous forme de paillettes solides ou sous forme
liquide contiennent essentiellement de l'acide sulfamique.
En solution aqueuse, l'acide sulfamique se comporte comme l'acide chlorhydrique.
De telles solutions détruisent les dépôts calcaires formés par le passage de l'eau.
Une intoxication par un détartrant à cafetière peut se produire et ce sont alors les signes
digestifs qui dominent : nausées, vomissements, sensation de brûlures. Dans ce cas, on
ne doit pas essayer de se faire vomir car un produit potentiellement caustique aggrave
les lésions au niveau de l'œsophage lorsqu'il est vomi.
L’acide benzoïque est un solide blanc utilisé comme conservateur dans les boissons
light (une calorie) comme fongicide et antibactérien sous le code E 210.
Il existe de nombreux doutes sur l’innocuité de cette substance qui peut déclencher
des réactions allergiques et entraîner une diminution du taux de glycine (un acide
aminé) pouvant avoir une influence sur la croissance.

A- Etude comparative des acides
On dispose de deux solutions S1 d’acide benzoïque et S2 d’acide sulfamique de même concentration molaire
Ci = 1,0.10-2 mol.L-1. On mesure leurs pH, on constate que celui de la solution S1 est de 3,12.
1. a. Ecrire l’équation de la réaction entre chacun des acides et l’eau.
b. Déterminer le pH de la solution d’acide sulfamique.
c. Justifier que l’acide benzoïque est un acide faible.
2. Proposer les représentations des deux couples acide/base.
3. Calculer le rapport [Acide benzoïque] / [Ion benzoate] dans la solution S1.
4. Justifier pourquoi :
a. une cafetière doit être suffisamment rincée après un détartrage.
b. les enfants en bas âge ne doivent pas consommer des boissons light.
5. On ajoute deux gouttes de rouge de métacrésol à chacune des solutions S1 et S2. Cet indicateur prendra-t-il la
même teinte?
B- Préparation de solutions acides
Sur un flacon contenant une solution d'acide sulfamique S, on lit les indications suivantes :
le pourcentage massique % en acide sulfamique : 10 % ;
: 1,1 g.mL-1.
1. a. Vérifier que la concentration molaire de l'acide dans cette solution se donne par la relation :
avec M la masse molaire de l’acide en g.mol-1 et
la masse volumique de la solution en g.L-1 et
retrouver la concentration molaire de la solution.
b. Quelle consigne de sécurité faut-il appliquer lors de la manipulation d’une telle solution ?
2. On réalise une dilution de la solution, à raison de deux cuillères à soupe pour 0.50 L de solution S’.
a. Calculer la concentration de la solution diluée ainsi préparée sachant que la contenance d'une cuillère
à soupe est égale à 10 mL.
b. Indiquer la verrerie dans laquelle la solution S’est préparée.
3. On ajoute à un volume d’eau distillée contenue dans une fiole jaugée de 200 mL une masse de 1g d’acide
benzoïque, on bouche, on agite suffisamment puis on complète avec de l’eau distillée jusqu’au trait de jauge.
Est-on sûr d’avoir une solution limpide ?

C- Nettoyage d’une cafetière par le détartrant
La solution d'acide sulfamique S’est utilisée comme détartrant pour cafetière électrique car elle réagit
avec le calcaire solide constitué d’ions calcium Ca2+ et d’ions carbonate CO32- dont les dépôts sont
souvent appelés tartre.
1. Retrouver parmi les espèces mises en solution celles qui sont à caractère acido-basique.
2. a. Placer sur un axe des pKa les couples acide-base correspondant aux espèces initialement présentes.
b. Ecrire l’équation-bilan de la réaction qui se produit lorsque la solution S’entre en contact avec le dépôt
de tartre.
c. Montrer que cette réaction peut être considérée comme totale.
3. Dans certaines conditions, quand on utilise ce détartrant, on peut observer un dégagement gazeux.
Quel est ce gaz ? Justifier sa formation.
D- Dosage acido-basique
Pour vérifier la valeur de l’indication sur le flacon contenant la solution S, on réalise un dosage
colorimétrique d’un volume de 20,0 mL de la solution S’ par une solution d'hydroxyde de sodium de
concentration molaire Cb = 5,0.10-2 mol.L-1. Le volume équivalent est VBE = 18,0 mL.
1. a. Ecrire l'équation du titrage acido-basique.
b. Définir l'équivalence.
c. Sous quel nom reconnaître la solution obtenue à l’équivalence ?
2. Nommer l’indicateur coloré choisi et indiquer la teinte qu’il prend à l’équivalence. Justifier.
3. a. Déterminer la concentration molaire de la solution S’.
b. Retrouver la concentration molaire de la solution commerciale d'acide sulfamique. Comparer à la valeur
fournie par le fabricant.
c. Vérifier si la solution commerciale est saturée.
TS
Corrigé de la composition de chimie Décembre 2009
I- Acides au quotidien
A- Etude comparative des acides
1. a. Réactions entre acides et eau et équations
* entre l’acide sulfamique et l’eau : NH2SO3H (aq) + H2O = NH2SO3-(aq) + H3O+ (1 pt)
* entre l’acide benzoïque et l’eau : C6H5CO2H (aq) + H2O = C6H5CO2 -(aq) + H3O+ (1 pt)
b. pH de la solution d’acide sulfamique
Comme en solution aqueuse, l'acide sulfamique se comporte comme l'acide chlorhydrique, il est donc un
acide fort (½ pt) et pH2 = - log Ci = - log 1,0.10-2 = 2 (½ pt)
c. L’acide benzoïque : un acide faible
D'après pH1 on aura [H3O+] qui est 10-pH1 = 1,0.10- 3,12 = 6,31.10-4 mol.L-1. (½ pt)
6,31.10-4 mol.L-1< 1,0.10-2 mol.L-1 et [H3O+] < Ci ainsi l’acide benzoïque est un acide faible. (½ pt)
2. Représentations des deux couples acide/base
Les couples sont : NH2SO3H (aq) / NH2SO3-(aq) (1 pt) et C6H5CO2H (aq) / C6H5CO2 -(aq) (1 pt)
Acide sulfamique/ Ion sulfamate Acide benzoïque/ Ion benzoate
3. Rapport [Acide benzoïque] / [Ion benzoate] dans la solution S1
Dans cette solution on a pH = pKa C6H5CO2H (aq) / C6H5CO2 -(aq) + log [C6H5CO2 -(aq)] (½ pt)

[C6H5CO2H (aq)]
[C6H5CO2 -(aq)] = 10 pH – pka
[C6H5CO2H (aq)]
[C6H5CO2 -(aq)] = 0,083 (½ pt)
[C6H5CO2H (aq)]
[C6H5CO2H (aq)] = 12 (½ pt)
[C6H5CO2 -(aq)]
4. Justification d’une action sécurisante et saine
a. Une cafetière doit être suffisamment rincée après un détartrage sinon on aura une intoxication par un
produit acide et corrosif. (1 pt)
b. Les enfants en bas âge ne doivent pas consommer des boissons light car l’acide benzoïque est accusé
de déclencher des réactions allergiques et entraîner une diminution du taux de glycine (un acide aminé)
pouvant avoir une influence sur la croissance. (1 pt)
5. Teinte de rouge de métacrésol dans les solutions S1 et S2 : identique ou différente ?
Dans des volumes de solutions S1 et S2 identiques (½ pt), cet indicateur aura sa teinte basique et jaune dans la solution
S1 de pH 3,12 (½ pt) alors qu’il prendra une teinte orange ou plus foncée dans la solution S1 à pH 2 qui correspond à
sa zone de virage (½ pt).
B- Préparation de solutions acides
1. a. Concentration molaire de l'acide sulfamique
Le pourcentage massique en acide sulfamique étant donné par la relation : % = m soluté .100
m solution
% = n.M (soluté) .100 = C soluté .M(soluté).100 (C soluté en mol.L-1 ; M soluté en g.mol-1 et
.V (solution)
solution (
solution en g.L-1) (½ pt)
D'où C soluté =
solution. % / M (soluté).100
C acide sulfamique = 1100. 10 / 97.100 = 1,13 mol.L-1 (½ pt)
b. Manipulation de solution et consigne de sécurité
Il faut mettre des gants et des lunettes, éviter le contact avec la peau et les habits et ajouter l’acide à l’eau (½ pt)
car il est corrosif (½ pt).
2. a. Concentration de la solution diluée
Le volume de la solution mère est de 20 mL (contenance de deux cuillères à soupe ou 10 mL.2) ; le volume
de la solution diluée S’est de 500 mL. (½ pt)
D'après la relation C solution diluée = V prélevé de la solution mère (½ pt)
C solution concentrée V préparé de la solution diluée
C solution diluée = 1,13.20/500 = 0,0452 mol.L-1= 4,52.10-2 mol.L-1 (½ pt)
b. Verrerie de préparation de S’
S’est préparée dans une fiole jaugée de 500 mL (1 pt).
3. Mélange eau et acide benzoïque : une solution limpide ?
C massique solution préparée = 1/ 0,2 = 5 g/L (½ pt)
Comme 5 g/L > 3 g/L et C massique > solubilité de l’acide benzoïque (½ pt) on aura des grains blancs d’acide restant
dans la fiole jaugée (½ pt).
C- Nettoyage par le détartrant
1. Espèces à caractère acido-basique
Ce sont l’ion H3O+ à caractère acide (½ pt) ; les ions carbonate CO32- à caractère basique (½ pt) ; l’eau à caractère
amphotère (½ pt) surtout que les ions calcium Ca2+ et sulfamate NH2SO3-(aq) sont indifférents (½ pt).
2. a- Classement des couples acide-base par pKa croissant (1pt ½)

b- Equation-bilan de la réaction de détartrage
La réaction la plus avancée a lieu entre l’acide le plus fort ayant
le pka le plus bas, l’ion H3O+ et la base la plus forte ayant le pka le
plus haut, l’ion CO32 -(aq) (1pt) d'où l’équation :
H3O+ (aq) + CO32 - (aq) = H2O + HCO3-(aq) (1pt)
c- Réaction considérée comme totale
Kr = [HCO3-] éq = 1 = 1 = 10 10,2 (½ pt)
[CO32 -] éq [H3O +] éq Ka 10-10,2
Kr > 104 (½ pt); la réaction est donc totale (½ pt).
3. Dégagement gazeux
Une réaction peut se produire entre les ions HCO3- formés, base
du couple CO2, H2O / HCO3 – et H3O + (½ pt)
HCO3 - (aq) + H3O + (aq) = CO2 (g) + 2H2O (1 pt)
Le gaz formé est donc le dioxyde de carbone (1 pt).
D- Dosage acido-basique
1. a. Equation de titrage d’un acide fort par une base forte (½ pt)
H3O+ + HO- (aq) = 2H2O (1 pt)
. b. Définition de l'équivalence
C’est quand les réactifs titrant et titré ont totalement réagi (1 pt).
c. Nom de la solution obtenue à l’équivalence
Il s’agit d’une solution aqueuse de sulfamate de sodium (1 pt ½).
2. Choix de l’indicateur coloré et teinte à l’équivalence.
On choisit le rouge neutre (½ pt) dont la zone de virage qui est 6,8-8,0 encadre le pHE qui est de 7 (1 pt).
L’indicateur prend une teinte légèrement jaune signe d’un milieu légèrement basique (1 pt).
3. a. Concentration molaire de la solution S’
n H3O+ titré = nHO- titrant (½ pt)
[H3O+]. V solution acide = [HO-]. V éq
[H3O+].20 = 0,05. 18,0
[H3O+] = 0,045 mol.L-1 (½ pt)
C solution S’ = [H3O+] = 0,045 mol.L-1 (½ pt)
3. b. Concentration molaire de la solution commerciale d'acide sulfamique
Le coefficient de dilution étant
k = V prélevé / V préparé = C solution S’ / C solution S (½ pt)
et comme on a prélevé 20 mL de la solution commerciale pour préparer 500 mL de la solution S’ ;
k = 20/500 = 1/25 (½ pt)
C solution commerciale S = C solution diluée.25 = 0,045.25 = 1,125 mol.L-1 (½ pt)
C solution S trouvée par dosage ~ C solution théorique selon l’étiquette
1,125 mol.L-1 ~ 1,13 mol.L-1 (½ pt)
c. Solution S saturée ?
La solution S d’acide sulfamique est saturée si sa concentration massique est égale à la solubilité à 200C (½ pt)
C massique = C molaire de S. M acide sulfamique. (½ pt)
C massique de S = 1,13.97 = 109,61 g/L (½ pt)
C massique < s car 109,61< 147 ainsi la solution n’est pas saturée. (½ pt)
 6
6
1
/
6
100%