TP de Physique 1 - Enseignement des Sciences Physiques

TP Terminale 24
1/2
TITRAGE pH-métrique et colorimétrique
pour déterminer la pureté d’un détartrant
Objectif : - Pratiquer une démarche expérimentale pour déterminer la concentration d’une espèce chimique
par titrage par le suivi pH-métrique et par la visualisation d’un changement de couleur.
On souhaite vérifier la masse d’acide sulfamique contenue dans 100 g de détartrant pour cafetière,
autrement dit, vérifier le pourcentage d’acide sulfamique dans le détartrant, appelé pureté du détartrant.
I. Quelques documents …
Le détartrant : Le détartrant se présente sous forme de poudre. Il est conditionné dans des sachets de 15 g ou 20 g.
Il est composé essentiellement d’acide sulfamique ( NH2SO3H ) assimilable à un acide fort.
Couples acide / base : NH2SO3H(s) / NH2SO3-(aq) H3O+(aq) / H2O(l) H2O(l) / HO-(aq) Tous incolores
Masses molaires atomiques (en g.mol-1) : M(H) = 1,0 M(O) = 16,0 M(N) = 14,0 M(S) = 32,1
Le matériel
Pour un binôme:
- agitateur magnétique et turbulent ;
- 3 béchers ;
- pipette de 10,0 mL + poire à pipeter;
- fiole jaugée de 100 mL, son bouchon et entonnoir adapté ;
- burette graduée de 25 mL ;
- papier pour sécher les électrodes ;
- sabot de pesée ou coupelle ;
- pissette d’eau distillée ;
- indicateurs colorés : Bleu de bromothymol (BBT) ;
hélianthine ; phénolphtaléine; rouge de méthyle ;
- 1 sachet de détartrant du commerce (pour observation) ;
- pH-mètre étalonné.
Pour l’ensemble de la classe :
- 2 balances au centigramme, 2 spatules et 2 réserves de
détartrant pour cafetière (ou plus) ;
- 1 L de solution de soude (hydroxyde de sodium) de
concentration cb = 0,100 mol.L-1.
Pourcentage massique : p
p
𝑚𝑎𝑐𝑖𝑑𝑒𝑠𝑢𝑙𝑓𝑎𝑚𝑖𝑞𝑢𝑒
𝑚𝑑𝑡𝑎𝑟𝑡𝑟𝑎𝑛𝑡
Quelques informations sur les indicateurs de
fin de réaction :
L’équivalence d’un titrage acido-basique
ou d’oxydoréduction peut parfois être mise en
évidence par la présence d’un indicateur de fin de
réaction.
* Si l’un des réactifs ou des produits est coloré,
alors l’équivalence, caractérisée par un
changement de réactif limitant, est visible par le
changement de coloration brutal de la solution.
* Si aucune des espèces réactives n’est colorée,
on peut employer un indicateur coloré (acido-
basique ou redox), qui change de couleur selon la
forme acide ou basique (ou oxydante ou
réductrice).
Dans le cas d’un titrage acido-
basique, l’équivalence correspond à un saut
important de pH. La zone de virage de
l’indicateur coloré doit être incluse dans le
saut de pH pour que la détermination du volume
équivalent soit la plus précise possible. En
pratique, on choisira un indicateur coloré dont la
zone de virage contient le pH obtenu à
l'équivalence. Il faudra en introduire 3-4 gouttes
dans l’échantillon en début de dosage. (Sinon la
réaction de titrage n’est plus unique !)
Quelques indicateurs présents au laboratoire

TP Terminale 24
2/2
II. Détermination expérimentale de la concentration molaire d’une solution du produit étudié.
1. Proposer un protocole expérimental.
On réalise une solution S0 du détartrant en introduisant m0 grammes de détartrant dans une
fiole jaugée de 100 mL dont on souhaite titrer un volume V0 = 10,0 mL.
1. Ecrire les équations des deux réactions se produisant à chaque étape.
2. Quelle valeur choisir pour m0 si l’échantillon dosé a pour volume V0 = 10,0 mL ? On souhaite un volume
équivalent autour de 10 mL, moitié du volume total de la burette.
3. Quelles techniques de dosage peut-on utiliser ?
Préciser, pour chaque méthode, le mode opératoire retenu et la façon de détecter l’équivalence.
2. Mettre en œuvre le protocole
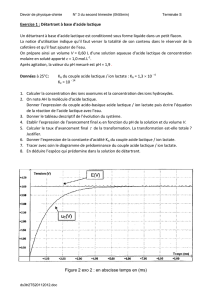
Réaliser le protocole et donner un tableau de mesures pour la méthode 1, celle avec électrodes.
Tracer et exploiter la courbe pour déterminer le volume et le pH à l’équivalence.
Réaliser le protocole et donner le volume à l’équivalence pour la méthode 2, celle sans électrode.
3. Exploiter les mesures
Après avoir écrit l’équation du titrage, relier littéralement le volume équivalent VbE et la concentration c0 de
S0 puis calculer la valeur de cette concentration c0 pour chaque méthode utilisée.
III. Détermination de la masse d’acide sulfamique dans 100 g de poudre de détartrant.
1. Calcul de la masse obtenue
Calculer la masse m d’acide sulfamique dans 100 g de détartrant en utilisant les deux résultats
expérimentaux. En déduire la pureté p, en pourcent, de ce détartrant.
2. Etude statistique des valeurs de m.
Binôme
1
Binôme
2
Binôme
3
Binôme
4
Binôme
5
Binôme
6
Binôme
7
Binôme
8
Moyenne
Ecart
type
Masse m
méthode 1
Masse m
méthode 2
1. Donner un encadrement de la valeur de m en considérant que l’incertitude absolue sur m est égale à
l’écart-type. Dans ce cas, m a une probabilité de 97 % de se retrouver dans cet intervalle, appelé intervalle
de confiance.
2. Calculer la moyenne des 16 mesures et l’écart-type de ces 16 mesures.
3. Une méthode semble-t-elle être meilleure que les autres ?
La méthode des tangentes :
Elle permet de repérer les coordonnées du
point équivalent E lors d’un titrage pH-métrique :
* Tracer, de part et d'autre du saut de pH, deux
tangentes (T1 & T2) à la courbe, parallèles entre elles.
* Tracer une droite perpendiculaire (D) à ces deux
tangentes : on obtient un segment entre les T1 et T2.
* Tracer la médiatrice au segment formé
précédemment, soit la parallèle à T1 et T2, à égale
distance de chacune.
=> Cette droite coupe la courbe pH = f (Vb)
au point équivalent E d’abscisse VbE.

TP Terminale 24
3/2
Déroulement
Proposer un protocole expérimental
La quantité de détartrant à peser est principalement fonction, à la fois, de la capacité de la burette (20-25 mL
ici), de la concentration de la solution titrante (0,1 mol/L) et du volume v0 de l’échantillon à doser (10 mL).
Le volume versé à l’équivalence peut être égal à environ la moitié de la capacité de la burette soit environ
10 mL.
Alors à l’équivalence nacide sulfamique = cbve q= 10-3 mol, pour une prise d’essai de 10 mL, ce qui fait une
concentration c0 de 0,1 mol/L environ.
Si 100% d’acide sulfamique dans la poudre, la masse à peser pour fabriquer 100 mL de solution S0 serait
m0= c0VfioleMacide sulfamique0,1x0,100x 100 = 1 g de poudre environ, en arrondissant à 100 g/mol la masse
molaire de l’acide sulfamique.
L’élève est amené à proposer de dissoudre environ « 1g dans 100 mL »
Quelles techniques de dosage peut-on utiliser ?
Dosage pH-métrique, colorimétrique (indicateur coloré).
Protocole:
Effectuer le dosage par la méthode 1 (pH-métrie: resserrer les mesures à 0,5 mL autour de
l’équivalence- valeurs entre 0 mL et 20 mL) puis par la méthode 2 (colorimétrie : indicateur = BBT).
Discuter le choix de l’indicateur à partir de la courbe pH-métrique. Réfléchir sur les changements de
couleur observés.
Détermination de c0:
Réaction totale de l’acide sulfamique sur l’eau (acide fort) => [H3O+(aq)]0=c0
Réaction de dosage des ions oxonium par les ions hydroxyde => A l'équivalence c0=cbvéq/v0.
Toutes les valeurs fournies avec 3 chiffres significatifs.
Détermination de m acide sulfamique dans 100 g de poudre:
mdans poudre pesée =c0VfioleMacide sulfamique puis m =100xmdans poudre pesée/m0
Etude statistique des valeurs de m
m a une probabilité d’environ 97 % de se trouver dans l’intervalle : [mmoy- σ ; mmoy+σ]
Une méthode semble-t-elle être meilleure que les autres ? Comparer les valeurs moyennes et l'écart-type de
chacune des méthodes avec la moyenne et l'écart-type global.
Exemples de valeurs trouvées avec une masse m0 de 1,00 g
Véq = 10,2 mL => donc c0 = 0,102 mol.L-1
Masse molaire de l'acide sulfamique : 97,1 g/mol.
Pureté correspondante: m= 0,990 g soit 99,0 %
Titrage de l’acide sulfamique dans un détartrant

TP Terminale 24
4/2
MATERIEL
Pour un binôme :
- agitateur magnétique et turbulent ;
- 3 béchers ;
- pipette de 10,0 mL + poire à pipeter;
- fiole jaugée de 100 mL, son bouchon et entonnoir adapté ;
- burette graduée de 25 mL ;
- papier pour sécher les électrodes ;
- sabot de pesée ou coupelle ;
- pissette d'eau distillée ;
- indicateurs colorés : Bleu de bromothymol (BBT) ; hélianthine ; phénolphtaléine; rouge de méthyle;
- 1 sachet de détartrant du commerce (pour observation).
- pH-mètre étalonné
- Papier millimétré
Pour l'ensemble de la classe :
- 2 balances au cg, 2 spatules et 2 réserves de détartrant pour cafetière ; (ou plus)
- 2 L de solution de soude (hydroxyde de sodium) FRAICHEMENT préparée de concentration
cb= 0,11 mol.L-1 étiquetée cb= 0,10 mol.L-1 (
1
)
1
Le pourcentage massique théorique de l’acide sulfamique dans le détartrant de cafetière est proche de 100% (98%-99%) . Une
erreur sur le volume équivalent de 0,1 mL pourrait engendrer un pourcentage massique supérieur à 100% ! De quoi déstabiliser
les élèves ! Donc on ne leur donne par la valeur théorique. En choisissant une solution de soude plus concentrée on est plus sur
d’avoir un pourcentage massique inférieur à 100%.
1
/
4
100%