DS n°2 : Expression de l`information génétique

Tale STL - 17/10/2015
Page 1 sur 9
DS n°2 : Expression de l’information génétique, réplication de l'ADN et
hérédité
I. La cellule
-------------
Dessin d’une cellule animale
I.1. Légender la cellule sur le polycopié.
I.2. Retrouver la taille de la cellule en utilisant les données reportées sur le dessin.
II. Réplication de l'ADN
II.1. Représenter un cycle cellulaire en détaillant les différentes phases (ne faites pas de graphique).
II.2. Quelle est la principale différence entre les chromosomes et la chromatine ?
II.3. À quelle étape du cycle cellulaire sont-ils respectivement présents ?
II.4. Indiquer la composition biochimique de la chromatine.
II.5. Schématiser et légender un chromosome.
2 µm

Tale STL - 17/10/2015
Page 2 sur 9
III. Hérédité
On connaît une forme de diabète sucré héréditaire, due à la synthèse d’une insuline anormale, inactive. La
transmission de maladie a été étudiée dans une famille dont l’arbre généalogique est représenté ci-
dessous :
III.1. Déterminer si l’allèle responsable de la maladie est dominant ou récessif. Justifier la réponse.
III.2. Préciser si le gène est porté par un autosome ou un chromosome sexuel. Justifier la réponse.
III.3. Le sujet IV3 n’ayant aucun antécédent de diabète familial, on le suppose homozygote. Indiquer la
probabilité pour le couple IV2 et IV3 d’avoir un enfant malade. Justifier la réponse.
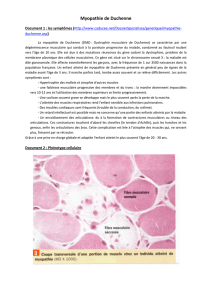
IV. Traitement de la myopathie de Duchenne (d'après un sujet de bac)
Les patients atteints de la myopathie de Duchenne sont majoritairement des garçons. Cette maladie est
liée à une modification d’une protéine, appelée dystrophine.
La recherche est très active concernant cette maladie. Un des objectifs est de développer de nouvelles
pistes thérapeutiques. Parmi elles, «le saut d’exon» est l’une des plus prometteuses.
L’objectif est de comprendre comment la thérapie génique appelée «saut d’exon» pourrait permettre le
traitement de cette pathologie.
La myopathie de Duchenne : une maladie génétique
Le document 1 présente l'arbre généalogique d'une famille où s'exprime la myopathie de Duchenne.
IV.1. Indiquer si l'allèle responsable de la maladie est récessif ou dominant ?
IV.2. A partir de l’analyse argumentée des données introductives et de l’arbre généalogique, justifier que le
gène est porté par un chromosome sexuel et préciser lequel.
3
2

Tale STL - 17/10/2015
Page 3 sur 9
Etude de la dystrophine
Le document 2 présente les séquences d’un fragment de l’allèle de référence (individu non atteint) noté s
et d’un fragment de l’allèle muté noté m du gène de la dystrophine.
IV.3. Indiquer les séquences d’ARN messager puis, à l’aide du code génétique fourni, les séquences
protéiques correspondant aux deux portions de séquences allèliques. En déduire les conséquences de la
mutation sur la séquence protéique issue de l’expression de l’allèle m.
La cellule possède une structure moléculaire, le protéasome, dont un des rôles est d’éliminer les protéines
présentant une conformation (structure tridimensionnelle) anormale.
Le document 3 présente le résultat d’un western blot, technique permettant la détection spécifique de la
dystrophine à partir de cellules musculaires de patients sains et de patients atteints par la myopathie de
Duchenne.
IV.4. A l’aide des informations fournies, proposer une explication aux résultats observés sur le western
blot.
IV.5. En déduire l’effet de la mutation sur la conformation de la protéine.
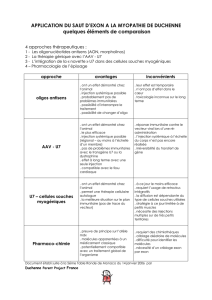
Saut d’exon
Pour essayer de traiter la myopathie de Duchenne, les scientifiques ont d’abord envisagé de réaliser une
thérapie génique en introduisant un allèle non muté dans l’ADN des cellules musculaires. Cette technique
étant difficile à mettre en oeuvre, le saut d’exon est une autre thérapie actuellement en cours de
recherche. Elle consiste à éliminer l’exon qui contient la mutation après un épissage sélectif. Son principe
est détaillé dans le document 4.
IV.6. A partir des informations du document 4, comparer simplement la séquence des protéines produites
en absence de saut d’exon et après la technique du saut d’exon.
IV.7. Préciser à quelle condition la technique du saut d’exon pourrait être un traitement efficace pour
soigner une pathologie telle que la myopathie de Duchenne.

Tale STL - 17/10/2015
Page 4 sur 9

Tale STL - 17/10/2015
Page 5 sur 9
 6
6
 7
7
 8
8
 9
9
1
/
9
100%