Cinétique Chimique : Suivi Temporel et Vitesse de Réaction
Telechargé par
badr boustakat

Unité 2 : suivi temporel d'une transformation chimique - vitesse de réaction chimie
2BAC.SC PC 7 Pr. Badr BOUSTAKAT
I- Les méthodes utilisées en cinétique chimique :
1- Méthodes physiques :
Il existe des grandeurs physiques qui dépendent par des lois simples, de la concentration de certaines
espèces présentes dans le milieu réactionnel. Parmi ces méthodes on trouve :
o La conductimétrie : Cette méthode peut être employée lorsque la transformation chimique
fait intervenir des ………. et que la conductivité du système varie.
o Spectrophotométrie: méthode utilisée quand la réaction met en jeu des espèces …………..
o pH-métrie: quand il intervient dans la réaction des ions tel que ……. ou ……….
o Mesure du volume ou de pression : quand la réaction fait intervenir des ……... Il est
possible de mesurer la pression à volume constant ou le volume à pression constante.
Ces méthodes présentent plusieurs avantages
Ne perturbe pas le système chimique,
Les mesures sont en général rapides
Les mesures peuvent se faire en continu,
Il est possible de travailler sur des quantités de matière de réactifs relativement faibles
C'est pour cela que ces techniques physiques sont de plus en plus utilisées dans les laboratoires spécialisés.
2- Méthode chimique : Le titrage
Le titrage ou le dosage est une méthode chimique qui permet de déterminer la concentration molaire d’une
espèce chimique (appelée le réactif ………) contenue dans la solution …………., en la faisant réagir avec
une espèce chimique (appelée le réactif ……..….) contenue dans la solution ……………..
On verse à l’aide de la burette la solution titrante dans la solution à titrer. Il se produit alors la
réaction de dosage qui met en jeu le réactif titré et le réactif titrant. il faut qu’elle soit :
…………. : Les deux réactifs, titré et titrant, réagissent selon
une seule et unique réaction.
…………..: Un des deux réactifs mis en présence doit
disparaître complètement.
…………. : Instantanée ou ne dure que de quelques secondes.
On verse la solution titrante jusqu’à ce que le réactif titré soit
totalement réagi ; on atteint alors …………………..
Repérage de l’équivalence : le repérage peut s’effectuer soit par :
Un changement de couleur du milieu réactionnel.
Un changement de couleur d’un indicateur coloré
introduit préalablement au dosage dans la solution à titrer.
A l’équivalence : le mélange est ………………………….,
d’où la relation d’équivalence pour l’équation de dosage suivante:
A B C D
La méthode chimique présente plusieurs certains inconvénients: Elle perturbe le système
chimique en effectuant des prélèvements ou il faut disposer de plusieurs échantillons, ce qui
nécessite de travailler sur des quantités relativement importantes de réactifs. En plus l'étude est
effectuée en discontinu.
Afin de caractériser quantitativement l'évolution temporelle d'un système chimique, il est nécessaire de
connaître sa composition à chaque instant. Diverses méthodes sont utilisées: certaines font appel à des
titrages, d'autres exploitent des mesures physiques.
................................................

Unité 2 : suivi temporel d'une transformation chimique - vitesse de réaction chimie
2BAC.SC PC 8 Pr. Badr BOUSTAKAT
II- Suivi de l’évolution temporelle d’une transformation par titrage direct
1- Activité expérimentale 1:
A l’instant t = 0 s, on mélange dans un bécher de 200mL un volume V1=50,0mL d’eau oxygénée H2O2 ,
de concentration C1= 5,4 .10 -2 mol.L-1, avec un volume V2 =50,0mL de solution aqueuse d’iodure de
potassium (K+(aq)+I-(aq)) , de concentration en soluté apporté C2=0,20mol.L-1, ainsi que quelques
gouttes d’acide sulfurique concentré.
A l’instant t1=2min, pour déterminer la quantité de matière du diiode dans le mélange
réactionnel, on prélève un volume V = 10 mL du mélange réactionnel à l’aide d’une pipette
jaugée.
Le prélèvement est alors refroidi rapidement en le versant dans un bécher contenant de l’eau
glacée.
Le diiode est dosé par une solution de thiosulfate de sodium (2Na+(aq)+S2O32(aq)) de concentration
C=0,10mol.L-1, en présence de quelques gouttes d’empois d’amidon . Cette réaction est rapide
et totale.
L’empois d’amidon joue le rôle d’indicateur coloré, il prend une teinte bleue en présence de
traces de diiode.
On note VE le volume de la solution de thiosulfate de sodium à l’équivalence.
Etape 1 : préparation du
mélange réactionnel
Etape 2 : préparation du
Prélèvement à t= 2 min
Etape 3 : Ajout de l’eau
glacée au Prélèvement
Etape 4 : Titrage du
Prélèvement
On répète cette opération à des différentes dates, puis on note les résultats trouvé.
1- Ecrire l’équation bilan de la réaction étudié entre les ions iodure et l’eau oxygénée, sachant que les
couples mise en jeu sont : I2/I- ; H2O2/H2O
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
2- Pourquoi ajoute-t-on le prélèvement à l’eau glacée rapidement à l’instant t1?
…………………………………………………………………………………………………………………………………….
3- Ecrire l’équation de la réaction de titrage. On donne les couples mise en jeu :
2/
II
et
22
4 6 2 3
/
S O S O
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
4- Ecrire la relation donnant la quantité de matière de diiode n(I2) apparu dans chaque prélèvement à
l’instant t en fonction de C et de VE.
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
Eau glacée
Prélèvement
Prélèvement

Unité 2 : suivi temporel d'une transformation chimique - vitesse de réaction chimie
2BAC.SC PC 9 Pr. Badr BOUSTAKAT
5- Dresser le tableau d’avancement de la réaction correspond à la transformation étudiée.
Equation chimique
Etat du système
Avancement
Quantités de matière en mol
Etat initial
0
En excès
En cours de
transformation
x
En excès
Etat final
xmax
En excès
6- Exprimer la quantité de matière de diiode nT(I2) apparu dans le mélange réactionnel à l’instant t. En
déduire l’avancement x en fonction de C et de VE.
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
7- On donne les valeurs du volume VE à l’équivalence. Compléter le tableau :
t (min)
0
2
6
10
15
20
30
40
50
60
70
VE (mL)
0
1,2
2,7
3,5
4,2
4,7
5,1
5,3
5,4
5,4
5,4
nT(I2) (mmol)
x (mmol)
8- Tracer la graphe x=f(t).
9- Déterminer l’avancement maximale xmax et déduire le temps de demi-réaction t1/2 qui vérifié la
relation :
max
12 2
x
xt
10- Tracer deux tangentes à la courbe aux instants t0 = 0 et t1 = 30 min. Comment varie le coefficient
directeur de ces tangentes ?
III- La vitesse volumique d’une réaction chimique :
1- Définition : La vitesse volumique d’une réaction, à une date t, est égale à la valeur de la
dérivée de l’avancement par rapport au temps à la date t, divisée par le volume V du
mélange réactionnel.
o L’unité de la vitesse volumique dans le système international est : …………………….
o Usuellement, si le volume est en litre on utilise …………………… . Et si la transformation est
très lente on peut utiliser …………….……… ou ……………………
10
20
30
40
50
60
70
80
t(min)
0
1
2
3
x(mmol)
...........................................

Unité 2 : suivi temporel d'une transformation chimique - vitesse de réaction chimie
2BAC.SC PC 10 Pr. Badr BOUSTAKAT
2- Détermination de la vitesse volumique :
Graphiquement, la dérivée de l'avancement par rapport au temps
i
t
dx
dt
à l'instant ti, représente la
pente de la tangente du graphe de x=f (t) à cet instant. Alors :
o On trace la tangente à la courbe à la date ti choisie,
o On Prend 2 points M1 et M2 appartenant à la tangente,
o On calcule le coefficient directeur de la tangente :
………………………………………………………………………..
………………………………………………………………………..
………………………………………………………………………..
o Pour obtenir la vitesse volumique à l'instant ti on devise
par le volume total de la solution V :
………………………………………………………………………..
………………………………………………………………………..
………………………………………………………………………..
3- Evolution de la vitesse de réaction au cours du temps :
o Graphiquement : Au cours du temps, on constate que les tangentes deviennent de plus en plus
………………., par conséquent leur coefficient directeur ……….. et tend vers ….. On peut donc
en déduire que la vitesse volumique de la réaction ……….. et tend vers … à la fin de la réaction.
o Cinétiquement : au cours du temps, les réactifs …………….……, par conséquence leurs
concentrations …………... Or les concentrations des réactifs sont des facteurs ………………. ;
alors la vitesse volumique de la réaction ……………… au cours du temps.
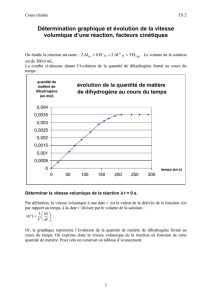
Application1 : Déterminer la valeur de la vitesse volumique de la réaction de l’activité 1, aux
dates t0 = 0 et t1 = 30 min.
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
IV- Temps de demi-réaction :
1- Définition : Le temps de demi-réaction, noté t1/2 est la durée nécessaire pour que
l'avancement x parvienne à la moitié de sa valeur finale xf.
Pour une transformation totale ……………. alors ………………….
2- Détermination :
Le temps de demi-réaction se détermine graphiquement
dès qu'on peut déterminer
f
x
; C'est l'abscisse du point
de la courbe x(t) dont l'ordonnée est
2
f
x
.
Le temps de demi-réaction permet d'évaluer la durée
nécessaire à l'achèvement de la transformation chimique
étudiée et déterminer la méthode de mesure
adaptée pour la suivre.
x
t
t(s)
x1
x2
t1
t2
0
T
xi
ti
x(mol)
.................................
0
x(mol)
t(s)

Unité 2 : suivi temporel d'une transformation chimique - vitesse de réaction chimie
2BAC.SC PC 11 Pr. Badr BOUSTAKAT
V- Suivi de l’évolution temporelle d’une transformation par mesure de pression.
1- Activités expérimentales 2:
On introduit un volume V= 200 mL d’acide chlorhydrique
( ) ( )3
aq aq
H O Cl
de concentration
11
1,0 .10 .
C mol L
dans un ballon de 500 mL muni d’un bouchon avec un trou.
Le manomètre est relié à un tube de verre introduit dans le trou du bouchon.
Un morceau de ruban de magnésium Mg de masse égale
à m= 86 mg est accroché à un fil fixé dans le bouchon
de telle sorte qu’une légère secousse puisse le faire tomber
dans l’acide chlorhydrique.
Pour conserver la température du mélange réactionnel
constante, on introduit le ballon dans un grand cristallisoir
contenant de l’eau à la température ambiante de
20C
.
Le morceau de magnésium est jeté dans l’acide chlorhydrique
à l’instant t=0s.
On donne:- Masse molaire : M (Mg) = 24,3 g.mol-1;
- Constante des gaz parfait R=8,314 (S.I)
Le tableau ci-dessous donne les valeurs de la pression enregistrée en fonction du temps :
t (s)
0
18
52
71
90
115
144
160
174
193
212
238
266
P (hPa)
1009
1040
1097
1127
1159
1198
1239
1261
1273
1287
1294
1297
1297
1- Ecrire l’équation bilan de la réaction. Les couples mise en jeu sont :
2/
Mg Mg
et
32
/
H O H
.
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
2- Quel est la nature du gaz produit ? Comment peut-on le mettre en évidence ?
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
3- Déterminer
0
p
la valeur de la pression d’air enfermé dans le ballon à l’instant t=0s ?
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
4- Déterminer l’avancement maximal xmax et le réactif limitant.
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
5- Pourquoi introduit on le ballon dans un grand cristallisoir contenant de l’eau ?
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
6- Exprimer la quantité de matière du dihydrogène n(H2) formé à l’instant t en fonction x :
…………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………….
1036
hPa
Mg
Manomètre
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%