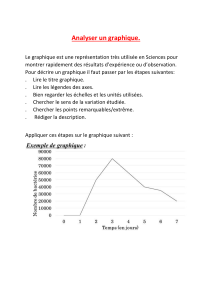
1ère S

Tale S
Chapitre n° 2
SUIVI TEMPOREL D’UNE TRANSFORMATION CHIMIQUE
Le chapitre précédent a permis de montrer que certaines réactions chimiques étaient lentes, et d’autres rapides : afin de
quantifier cette notion, il est nécessaire d’introduire les notions de vitesse de réaction et de temps de demi-réaction.
I- Notion de vitesse volumique de réaction
1°) Définition
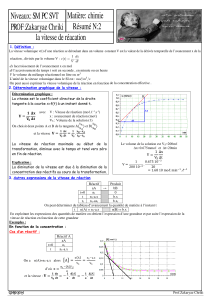
La vitesse volumique v de réaction est définie par :
Où V est
dx :
dt :
Rq. : Compte-tenu des volumes de solution utilisés en laboratoire, cette vitesse est couramment exprimée en
, ou en , voire en pour des réactions très lentes.
2°) Détermination de sa valeur
a) Principe •La vitesse volumique de la réaction étant fonction de l’avancement, il est nécessaire de connaître la courbe
x = f(t) pour déterminer sa valeur.
•La valeur du volume V de la solution est constante au cours du temps.
•La valeur de la dérivée par rapport au temps de l’avancement
dt
dx
peut s’obtenir de deux manières différentes.
b) Méthodes •La méthode graphique nécessite le tracé de la tangente à la courbe x = f(t) à la date t donnée. La valeur de son
coefficient directeur sera égale à celle de
dt
dx
.
•La méthode analytique nécessite l’utilisation un tableur : connaissant les valeurs de l’avancement x pour
différentes dates t, la valeur du quotient
1n1n
1n1n
n
tt
xx
k
−+
−+
−
−
=
sera égale à celle de
dt
dx
.
3°) É volution de la vitesse de réaction au cours du temps
a) Utilisation du graphique x = f(t) •En général, l’avancement x d’une réaction évolue,
en fonction du temps, selon la courbe suivante :
•Déterminons la vitesse volumique de la réaction à
la date t = 20 min. pour un mélange réactionnel de
500 mL :
•La détermination du coefficient directeur de la tangente à la courbe pour différentes dates montrerait que la
vitesse de réaction au cours du temps.
b) Interprétation
- 1 -
x = f(t)
0
1
2
3
4
5
6
7
8
9
10
11
0 10 20 30 40 50 60 70 80 90 100
t (en min.)
x (en mol)
x (en mol)
t (en min.)

4°) Facteurs influant sur la vitesse de réaction
Comme les expériences du chapitre précédent l’ont montré, l’augmentation de la température et de la concentration
initiale des réactifs a pour effet
II- Notion de temps de demi-réaction
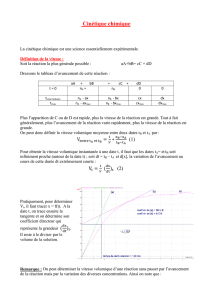
1°) Définition
Le temps de demi-réaction est la durée au bout de laquelle l’avancement x est égal à la moitié de l’avancement final xf.
À t = t½ : x =
Rq. : Lorsque la transformation est totale : xf = Donc : à t = t½ : x =
2°) Détermination de sa valeur
La méthode graphique ou la méthode analytique peuvent être utilisées.
x = f(t)
0
1
2
3
4
5
6
7
8
9
10
11
0 10 20 30 40 50 60 70 80 90 100
t (en min.)
x (en mol)
III-Les techniques de suivi expérimental de cinétique de réaction
1°)Les techniques dites chimiques
Ces techniques sont qualifiées de chimiques, car elles utilisent une réaction chimique pour déterminer la
concentration de l’espèce étudiée.
Ces techniques possèdent néanmoins certains inconvénients :
•l’étude nécessite des prélèvements à intervalles de temps réguliers : elle n’est donc que discontinue ;
•le prélèvement étudié doit subir un titrage : la réaction étudiée doit donc être suffisamment lente par rapport à
celle utilisée pour le titrage ;
•le milieu réactionnel dans lequel à lieu la réaction étudiée doit être suffisamment volumineux, du fait des
prélèvements répétés.
2°)Les techniques dites physiques
Ces techniques sont qualifiées de physiques, car elles utilisent des lois physiques reliant une grandeur physique
mesurable et la concentration de l’espèce étudiée. Plusieurs méthodes existent :
a) La conductimétrie
La mesure de la conductivité du milieu réactionnel peut être utilisée chaque fois que la réaction étudiée fait
intervenir des ions dont la concentration évolue.
b) La spectrophotométrie
Cette technique peut être utilisée chaque fois que la réaction étudiée fait intervenir des espèces colorées.
c) La pH-métrie
Cette technique peut être utilisée chaque fois que la réaction étudiée fait intervenir les ions hydronium (ou
oxonium) ou hydroxyde .
d) Cas des gaz
Lorsque la réaction fait intervenir des gaz, la mesure de la pression à volume constant (ou du volume à pression
constante) permet, grâce à la loi des gaz parfaits ( ), d’effectuer un suivi cinétique.
Toutes ces techniques physiques possèdent plusieurs avantages :
•Les mesures sont rapides et peuvent être effectuées de manière continue ;
•Il est possible de travailler sur des petites quantités de matière.
- 2 -
x (en mol)
t (en min.)
1
/
2
100%