Thème : Comprendre (lois et modèles), temps mouvement et

Remarque : les photographies sont libres de droit.
Thème : Comprendre (lois et modèles), temps mouvement et évolution
Type de ressources : Ressource à caractère expérimental.
Notions et contenus :
Pratiquer une démarche expérimentale afin de suivre dans le temps et estimer la
durée d’une synthèse organique
Mettre en œuvre une démarche expérimentale pour mettre en évidence quelques
paramètres influençant l’évolution temporelle d’une réaction chimique :
concentration, température.
Déterminer un temps de demi-réaction.
Compétence travaillée ou évaluée :
Mener des expériences assistées par ordinateur.
Porter un jugement critique sur la pertinence des résultats obtenus.
Mettre en œuvre un raisonnement.
Exploiter des graphiques.
Extraire une information des signaux délivrés par un capteur.
Nature de l’activité :
Expérience de chimie assistée par ordinateur.
Résumé (en 5 lignes au plus) :
Utiliser l’interface Sysam et un transmetteur conductimétrique afin de suivre la cinétique
chimique de la synthèse d’un alcool (le 2-méthylpropan-2-ol), par hydrolyse d’un dérivé
halogéné (le 2-chloro-2-méthylpropane).
Le facteur cinétique pris en compte est la température mais on peut aussi réaliser cette
expérience en faisant varier la concentration molaire du dérivé halogéné.
Mots clefs : cinétique chimique, facteurs influençant la vitesse de réaction, durée d’une
réaction chimique, vitesse de réaction.
Académie où a été produite la ressource : Académie de Strasbourg

Sciences physiques
Programme de terminale S, Comprendre, Temps mouvement et évolution
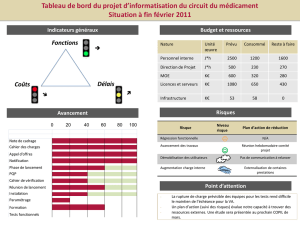
Etude de la cinétique chimique de la synthèse du
2-méthylpropan-2-ol par hydrolyse
du 2-chloro-2-méthylpropane.
Problématiques :
Comment suivre dans le temps une synthèse
organique et estimer sa durée ?
Est-ce que la température est un facteur qui aura une
influence sur la durée de la synthèse organique ?
1. Principe de la manipulation
On étudie, à des températures différentes, la réaction d’hydrolyse du 2-chloro-2-méthylpropane
qui produit de l’acide chlorhydrique (H3O+ (aq) + Cl- (aq)) et du 2-méthylpropan-2-ol.
Le 2-méthylpropan-2-ol ainsi synthétisé présente un intérêt industriel puisqu’il est utilisé comme
solvant, dans les dissolvants pour peintures, dans les carburants pour augmenter l’indice d’octane
et comme intermédiaire dans la synthèse d’autres produits chimiques comme les parfums.
CCl(CH3)3 (l) +2 H2O(l) = HOC(CH3)3(l) + H3O+ (aq) + Cl- (aq)
2-chloro-2-méthylpropane 2-méthylpropan-2-ol
C’est à l’aide d’une sonde de conductimétrie branchée sur l’interface Sysam que nous allons suivre
l’évolution au cours du temps de cette synthèse.
Une cellule de conductimétrie est constituée de deux plaques métalliques, parallèles, de même
surface S, distantes d’une longueur L et reliées chacune à une borne différente d’un générateur. On
rappelle que dans une solution aqueuse, le passage du courant est assuré par le déplacement
d’ions. En conséquent, la cellule de conductimétrie mesurera une grandeur appelée conductivité,
notée σ exprimée en Siemens.mètre-1 (ou S.m-1) et dont la valeur variera avec la concentration
molaire des ions présents. Cette grandeur est liée à l’aptitude de la solution à laisser les ions se
déplacer librement d’une plaque métallique à l’autre ; plus il y en aura et plus la conductivité sera
grande (et inversement).
2. Manipulation
Chlore
Oxygène
Photographie 1
Photographie 2

2)A) Préparation de l’outil informatique : interface et sonde.
Ouvrir le logiciel Latispro.
Relier l’interface Sysam au secteur et à l’ordinateur.
Brancher le transmetteur conductimétrique à l’interface
Sysam (voir la photographie 2).
Le transmetteur conductimétrique est aussitôt reconnu
par l’interface.
Choisir Conductance et Conductivité
La fenêtre ci-contre s’ouvre afin de réaliser l’étalonnage
de la sonde : cocher TCM3, taper le coefficient de cellule
qui est environ de 1,1 et affiner le réglage avec une
solution étalon en tournant le bouton « coefficient de
cellule » du transmetteur.
Choisir Acquisition temporelle
Points 1350, total 45 min.
Ne garder comme fenêtre ouverte que la conductivité
et fermer la conductance.
Remarque : si vous souhaitez suivre l’évolution de la conductivité
en fonction du temps il est possible d’avoir un afficheur numérique :
puis cliquer sur
fenêtres, mosaïque auto ou F5.
2)B) Préparation des réactifs.
Prélever 50,0 mL d’eau distillée à l’aide d’une pipette.
Prélever 50,0 mL d’éthanol absolu à l’aide d’une pipette.
Prélever 1,0 mL de 2-chloro-2-méthylpropane à l’aide d’une pipette.
Dans deux erlenmeyers différents, et à l’aide d’un bain thermostatique,
porter l’eau et le mélange {éthanol absolu, 2-chloro-2-méthylpropane}
à la température souhaitée. Attendre l’équilibre thermique.
Remarque : le 2-chloro-2-méthylpropane est peu soluble dans l’eau pour cette raison on en
prépare une solution alcoolique.
2)C) Déclenchement de la prise de mesures.
Quand l’équilibre thermique des solutions est atteint, verser l’eau dans le bécher réactionnel.
Le placer sur un agitateur magnétique réglé sur une agitation modérée.
Y placer la sonde conductimétrique. (voir la photographie 1)
Y rajouter le mélange {éthanol absolu, 2-chloro-2-méthylpropane} et en même temps
déclencher les mesures en appuyant sur F10.

3. Exploitation
Graphique 1
Graphique 2

Données :
Masse molaire du 2-chloro-2-méthylpropane M = 92,5 g.mol-1.
Densité du 2-chloro-2-méthylpropane : d= 0,85.
Masse volumique de l’eau : ρ eau = 1,0 kg.L-1 (on la considère constante quelque soit la
température).
3)A) A quelle famille organique appartient le 2-chloro-2-méthylpropane ?
3)B) Donner les formules semi-développées des composés organiques.
3)C) Expliquer pourquoi on peut suivre la synthèse du 2-méthylpropan-2-ol par conductimétrie.
3)D) En observant l’allure des graphiques préciser si cette réaction de synthèse est rapide ou
lente ?
3)E) Peut-on estimer la durée de cette synthèse organique à 40°C ? Et à 25°C ? Expliquer.
3)F) Déterminer la quantité de matière n0 de 2-chloro-2-méthylpropane introduite dans le bécher
à t=0s.
3)G) Dresser un tableau d’avancement du système chimique contenu dans le bécher
réactionnel.
3)H) Déterminer la valeur de l’avancement maximal xmax.
3)I) En utilisant les graphiques 1 et 2, déterminer quand c’est possible, les valeurs des
conductivités à t=0 s et à t= final.
3)J) La conductivité σ (t) = K. x(t) est proportionnelle à l’avancement. Déterminer la valeur de K
à l’aide du graphique 2 puis préciser par une analyse dimensionnelle les unités de K.
3)K) Montrer qu’à l’instant t, l’avancement x(t) est donné par la relation x(t) =n0
3)L) On appelle temps de demi réaction t 1/2, la durée au bout de laquelle la valeur de
l’avancement x de la réaction est égale à la moitié de sa valeur maximale xmax.
Expliquer comment et pourquoi à partir du graphique σ=f(t), on peut déterminer le
temps de demi-réaction.
Déterminer à partir du graphique 2, le temps de demi-réaction t 1/2.
3)M) On donne la définition de la vitesse volumique d’une réaction :
v(t) = .
v(t): vitesse volumique de réaction (en
mol.m-3.s-1)
V: volume de la solution (en m3)
dx: variation de l'avancement (en mol)
dt: durée de la variation (en s)
Le rapport dx/dt représente la dérivée
de l’avancement par rapport au temps.
Graphiquement, on trace la tangente
à la courbe x=f(t) à la date t choisie. La
valeur du rapport dx/dt est égal au
coefficient directeur de cette tangente.
A l’aide de la question 3)K), exprimer v(t) en fonction de V, n0, σ(t) et σ final.
A l’aide du graphique 2, calculer la vitesse volumique initiale v t=0, pour 40°C,
en présentant clairement la démarche. Décrire l’évolution de cette vitesse au
cours du temps, en précisant le raisonnement utilisé.
1
/
5
100%