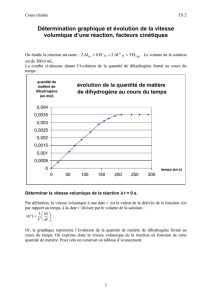
Vitesse de reaction.

Vitesse de réaction.
Une transformation chimique peut être quantitativement suivie à l'aide de courbes traduisant l'évolution, dans le temps,
de la quantité de matière d'une espèce du système.
Cela permet de mesurer la vitesse instantanée de la réaction et le temps de demi-réaction.
I -Avancement d'une réaction chimique : (Rappels)
Equation : aA + bB = cC + dD (A, B : réactifs ; C, D : produits)
x
: avancement de la réaction
n(A)i
: quantité de matière initiale de A
n(A)
: quantité de matière de A à la date t
n(A)f
: quantité de matière finale de A
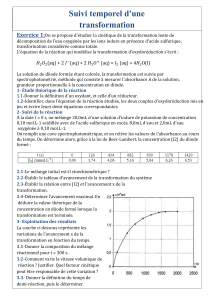
Tableau (d'avancement) d'évolution de la réaction :
Equation chimique
aA + bB = cC + dD
Etat du système
Avanc.
Quantité de matière en mol
Etat initial
0
n(A)i
n(B)i
n(C)i= 0
n(D)i= 0
En cours de transformation
x
n(A) = n(A)i - a.x
n(B) = n(B)i - b.x
n(C) = c.x
n(D) = d.x
Etat final
xf
n(A)i - a.xf
n(B)i - b.xf
c.xf
d.xf
II-Vitesse volumique de réaction :
1-Définition :
La vitesse volumique de réaction vr à la date t est égale à la dérivée par rapport au temps de l’avancement de la
réaction à la date t, divisé par le volume total V du mélange réactionnel de la solution.
avec
vr : vitesse volumique de réaction ( mol.L-1.s-1)
V : volume de la solution (L)
: dérivée de l’avancement x par rapport au temps (mol.s-1).
Remarques:
-Le volume V peut être exprimé en m3 , la vitesse de réaction est alors exprimée en mol.m-3.s-1.
-Si la transformation est lente ou très lente la durée peut être exprimée en minute ou en heure.
La vitesse de réaction est alors exprimée en mol.L-1.min-1 ou en mol.L-1.h-1.
2-Détermination de la vitesse volumique de réaction.
Il faut déterminer le volume V et l'avancement x .
x peut être déterminé grâce à un graphique, un tableau de mesures (graphique à tracer) ou un tableau d'avancement (il
faut alors connaître, soit par une méthode chimique soit par une méthode physique, l'évolution de la concentration de l'un
des réactifs ou de l'un des produits)
Deux méthodes.
a- Graphiquement:
-Tracer la courbe de l'avancement en fonction du temps x = f(t)
-Déterminer graphiquement la dérivée de l'avancement par rapport au
temps à l'instant t1
On trace la tangente à la courbe x = f(t) à la date t1 choisie.
La valeur du rapport est égale au coefficient directeur de cette
tangente (soit la pente de la tangente au point M1(t1,x1)).
d’ou
b- Par le calcul: Un tableur calcule la vitesse vr à partir des valeurs de V, ti et xi.

3-Evolution de la vitesse volumique de réaction au cours du temps.
Au cours du temps les réactifs disparaissent donc leur concentration diminue.
Or la concentration des réactifs est un facteur cinétique.
Donc en générale au cours du temps la vitesse volumique de réaction diminue.
4-Facteurs influant sur la vitesse volumique de réaction
-la température.
Pour deux températures de réaction θ1 et θ2 avec θ2 > θ1.
Soit v1 et v2 les vitesses de réaction initiale correspondantes,
on a v2 > v1.
La vitesse de réaction initiale est d’autant plus grande que
la température est élevée.
En fait plus la température est élevée plus l’agitation des espèces
chimiques est grande, la probabilité que deux espèces chimiques
se rencontrent augmente,
donc la vitesse volumique de réaction est plus grande.
-La concentration initiale des réactifs.
Pour deux concentrations initiales c1 et c2 avec c2 > c1.
Soit v1 et v2 les vitesses de réaction initiale correspondantes,
on a v2 > v1.
La vitesse de réaction initiale augmente quand la concentration
initiale des réactifs augmente
En fait si la concentration est plus grande, la probabilité que deux
espèces chimiques se rencontrent augmente,
donc la vitesse volumique de réaction est plus grande.
III-Temps de demi-réaction.
1-Définition.
Le temps de demi-réaction est la durée au bout de laquelle l'avancement x est égal à la moitié de l'avancement
final xf :
Donc quand : t = t ½ on a
Si la transformation est totale, xf = xmax ; à t = t1/2 ,
2-Détermination de t1/2.
On calcule xmax à partir du réactif limitant dans le tableau d'avancement.
puis :
En reportant cette valeur sur la courbe x=f(t) on déduit par simple lecture
graphique la valeur de t1/2.
Remarque :
Pour deux températures de réaction θ1 et θ2 avec θ2 > θ1 , on a :
x (mol)
t (s)
θ2 > θ1
v1
θ1
v2
v1
x (mol)
t (s)
c2 > c1
c1
v2

IV-Exemple :
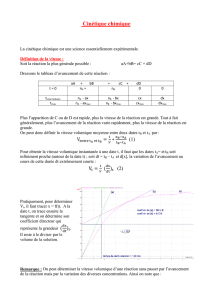
évolution d'un mélange de deux solutions, l'une d'ions iodure I-(aq) l'autre d'ions péroxodisulfate S2O82-(aq)
Expérience :On verse dans un bêcher 100 mL d'une solution d'iodure de potassium de concentration molaire 0,400
mol.L-1. On y ajoute 100 mL d'une solution de péroxodisulfate de potassium de concentration molaire 0,036 mol.L-1 et on
déclenche le chronomètre au même instant (t = 0 ).
On prélève 10 mL du mélange réactionnel, à la date t i , que l'on verse dans un bêcher contenant de l'eau glacée (on effectue
ainsi une trempe : la transformation est arrêtée grâce à une dilution et un refroidissement simultanés).
On refait les mêmes opérations pour d'autres dates.
On titre chacun des prélèvements par une solution de thiosulfate de sodium de concentration molaire 0,020 mol.L-1.
1-Ecrire l’équation de la réaction d'oxydation des ions iodure
I-(aq)
par les ions
péroxodisulfate
S2O82-(aq).
Les couples oxydant/réducteur intervenant sont :I2(aq)/I-(aq) et S2O82-(aq)/S042-(aq).
2-Ecrire la relation entre n
I2
et l’avancement x.
Quantité de matière de diiode formé :
t (min)
0
3
6
9
12
16
20
30
40
50
60
2
I
n
(x10-3mol)
0,0
0,5
1,0
1,4
1,7
2,1
2,3
2,8
3,1
3,2
3,3
v (x10-4 mol.L-1.min-1)
10
8,0
7,0
6,0
5,0
4,0
3,0
1,5
1,0
0,5
Graphique : évolution de l’avancement x en fonction du temps t : x = f(t)
0.0
0.5
1.0
1.5
2.0
2.5
3.0
3.5
010 20 30 40 50 60
3-Comment évolue la vitesse volumique de réaction en fonction du temps ?
4-Calculer le temps de demi-réaction.
x (x 10-3 mol)
t (min)
1
/
3
100%