Centre Régional des Métiers
De l'Enseignement et de la
Formation Mohamed V de Safi
Promotion 2019
Cartes techniques des travaux pratiques de
L'Estérification et de l'Hydrolyse
Réalisé par :
Sofiane AIT BEN MILOUD
Ilham AIT ALLA
Abdelilah KHATAMI
Zakaria KHIA
Ismail EL MASSOUDI
Abderrazak FELAHI
Encadré par : Mr. Abdellatif OUAHDANI

Estérification : Synthèse de l’acétate d’isoamyle
(Arôme de banane)
But de la manipulation :
Cette manipulation vise à synthétiser l’acétate d’isoamyle (Arôme de banane) utilisé comme
additifs alimentaires, à partir de l’anhydride acétique et de l’alcool isoamylique. Puis le calcul du
rendement molaire.
Liste des produits et du matériel utilisés :
Produits : l’Anhydride acétique, l’alcool isoamylique, l’acide sulfurique, l’eau distillée, le
bicarbonate de sodium aqueux, sulfate de sodium (Na2SO4).
Matériel : ballon monocol de 50 ml, réfrigérant droit, ampoule à décanter, éprouvette, pipette,
béchers, pierre ponce, chauffe ballon.
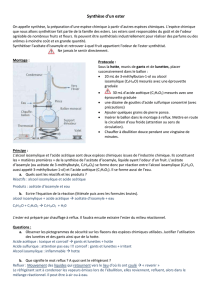
Protocole expérimental :
111
2
345678
911
0
2
345678
9
110
Sortie d'eau
Entrée d'eau
Réfrigérant droit
Ballon monocol
chauffe-ballon
Les étapes de préparation et extraction de l’acétate d’isomyle (arome de banane) :
Préparation
1. Dans un ballon bien sec, on introduit 5 ml d’alcool isoamylique à l’aide d’une pipette.
2. Sous la hotte, on y ajoute 10 ml d’anhydride acétique à l’aide d’une éprouvette.
3. On ajoute dans le ballon quelques grains de pierre ponce et quelques gouttes d’acide
sulfurique.

4. On réalise le montage montré dans la figure ci-dessus.
5. On chauffe à reflux pendant 40 min environ.
Extraction
Après refroidissement du mélange :
1. On verse le contenu du ballon dans l’ampoule à décanter.
2. On y ajoute de l’eau pour détruire le reste de l’anhydride acétique en le transformant en
acide acétique, on agite le mélange tout en ouvrant le robinet de l’ampoule pour dégazer
le mélange.
3. Après décantation et séparation des phases, on ajout sur la phase organique une quantité
de bicarbonate de sodium pour transformer le reste d’acide acétique en acétate de sodium
qui est soluble dans la phase aqueuse.
4. après séparation des phases, on verse la phase organique dans un bêcher et on y ajoute le
sulfate de sodium (Na2SO4), pour éliminer les molécules d’eau dissoutes dans l’ester.
5. on filtre le mélange sur papier filtre, et on calcule la masse de notre produite.
Équation de la réaction :
CH3OH
CH3
+CH3O CH3
OOH+
CH3O
O
CH3
CH3+CH3OH
O
Alcool isoamylique Anhydride acétique Acétate d'isoamyle Acide acétique
Calcule de rendement :
L’alcool isoamylique
C =8.98mol /l
V=5ml
N=0.0449mol
L’acétate d’isoamyle
m =3.73g
M =130.19g/mol
N=0.0286mol
Réactif limitant est l’alcool isoamylique, donc le nombre de mol théorique égale au nombre de
mol de cet alcool.
𝑅 = 𝑁𝑜𝑚𝑏𝑟𝑒 𝑑𝑒 𝑚𝑜𝑙 𝑒𝑥𝑝é𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙𝑒
𝑁𝑜𝑚𝑏𝑟𝑒 𝑑𝑒 𝑚𝑜𝑙 𝑡ℎé𝑜𝑟𝑖𝑞𝑢𝑒 =0.0286
0.0449 ×100 =63.80%

Hydrolyse : saponification (préparation du savon)
But de la manipulation :
Cette manipulation vise à synthétiser le carboxylate de sodium (savon) utilisé pour le dégraissage
et le lavage, à partir d'une solution concentrée de base (hydroxyde de sodium) et d’un corps gras
(huile alimentaire) qui contient le triglycéride.
Liste des produits et du matériel utilisés :
Produits : huile alimentaire, solution concentrée de NaOH (8 mol/l), l’éthanol, l’eau distillée,
solution de chlorure de sodium saturée.
Matériel : ballon monocol de 250 ml, réfrigérant à eau, erlenmeyer, pierre ponce, chauffe ballon,
Büchner, papier filtre.
Protocole expérimental :
Les étapes de préparation et filtration du savon (carboxylate de sodium):
Préparation
1. Dans un ballon, verser mélange réactionnel qui se compose de :
20 ml d'huile alimentaire (huile d’olive).
20 ml de solution d’hydroxyde de sodium concentrée (c = 8 mol/l).
111
2
345678
911
0
2
345678
9
110
Sortie d'eau
Entrée d'eau
Réfrigérant droit
Ballon monocol
chauffe-ballon

20 ml d'éthanol.
Introduire quelques grains de pierre ponce.
2. Adapter un réfrigérant à eau.
3. Placer le ballon dans un chauffe-ballon posé sur un support élévateur.
4. Porter le contenu du ballon à ébullition douce pendant 30 minutes.
filtration
6. Enlever le chauffe-ballon et laisse refroidir le contenu du ballon à température ambiante
pendant quelques minutes.
7. Verser, avec précaution, en agitant, le contenu du ballon dans environ 50 ml d’une solution
de chlorure de sodium saturée.
8. Laisser reposer.
9. Filtrer le solide sur Büchner. Le rincer à l’eau.
Équation de la réaction :
Conclusions :
L'estérification est une réaction de chimie organique au cours de laquelle un groupe
fonctionnel ester R1-COO-R2 est obtenu par condensation d'un groupe acide
carboxylique R1-COOH(ou anhydride d’acide) et d'un groupe alcool R2-OH ainsi
que formation d'eau H2O(ou d’un acide carboxylique).
On appelle hydrolyse toute réaction chimique au cours de laquelle il y a rupture de
liaison d'une molécule par l'eau. L'hydrolyse d'un ester conduit par exemple à la
formation d'un acide carboxylique et d'un alcool.
Précautions de sécurités :
les solutions concentrées doivent être manipulé sous la hotte.
porter des lunettes lors de la préparation des mélanges.
Porter une blouse de chimie.
 6
6
1
/
6
100%