Saint Louis 2015 Cuvier C. Giacchetti S..pptm

!"#$%&'#()*+,-.*
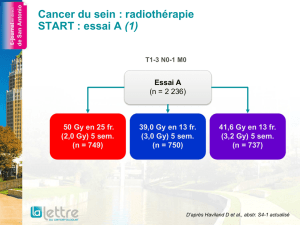
!"#$%#&'#('$)*+,$$
%!-.$)*+/$

/01213456789:139*
1;1<* <:!5*

• Objectifs
• Principal : incidence de cancer du sein (CCIS inclus)
• Secondaires : autres cancers, mortalité par cancer
du sein, mortalité toutes causes, effets indésirables
Étude IBIS-I
International Breast Intervention Study
Schéma
$
5 ans 16,0 ans
Suivi médian
Femmes à haut risque
(n = 7 154)
35-70 ans
Tamoxifène
(n = 3 579)
Placebo
(n = 3 575)
Cuzick J et al., abstr. S3-07 actualisé

Étude IBIS-I
Résultats
$
0
2
4
6
8
10
12
14
0 2 4 6 8 10 12 14 16 18 20
Années
incidence cumulée (%)
3,3%
6,3%
6,3%
4,6%
HR (IC95)
Tous 163 vs 226 0,72 (0,59-0,88)
Infiltrant
RE+
100 vs 145 0,68 (0,53-0,88)
HR (IC95)
88 vs 124 0,70 (0,53-0,91)
60 vs 93 0,63 (0,45-0,87)
Placebo
Tamoxifène
Incidence cumulée des cancers du sein
Cuzick J et al., abstr. S3-07 actualisé

Étude IBIS-I
Résultats
0$
Placebo
(n = 3 575)
Tamoxifène
(n = 3 579) Δ OR (IC95)
Total, n (%) 166 (4,6) 182 (5,1) +20 1,10 (0,88-1,37)
Sein (n) 9 18 +9 1,19 (0,68-2,10)
Endomètre (n) 0 5 +5
1,06 (0,77-1,47)
Autres (n) 78 83 +5
Cardiovasculaire
A/V (n) 62 63 +1
Décès
Cuzick J et al., abstr. S3-07 actualisé
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
1
/
60
100%