Avril 2012 C a n c e r

Etablissement Publique Hospitalier
Avril 2012
Guerrara Santé
Journal Médical Trimestriel
Comité Médical de l'EPH Guerrara - Ghardaïa
Dossier
C a n c e r
d u s e i n
Polytraumatisme :
Conduite à tenir
Pédiatrie :
Mort subite du Nourrisson
Guerrara Santé Revue Médico-ed Guerrara Ghardaïa Avril 2012 N°01
Contacts : Adresse : EPH Mohamed CHERIFI, route dEl-Hadjira, Guerrara, Ghardaïa ;
Télou Fax :

Avant-propos
Dans la vie il y a deux catégories d'individus:
- ceux qui regardent le monde tel qu'il est et se demandent pourquoi!?
- ceux qui imaginent le monde tel qu'il devrait être et se disent: pourquoi pas?
"George-Bernard Show"
La démarche qualité-gestion de l'établissement publique hospitalier, constitue un
travail de fond qui mobilise l'ensemble de nos professionnels (équipe médicale,
paramédicale et administrative) autour d'un objectif commun : Mieux travailler
ensemble pour assurer une prise en charge de qualité et améliorer la satisfaction de
nos patients.
Je pense que beaucoup peuvent apporter leur pierre à la construction, non
seulement dans ce petit EPH, mais aussi dans toute la ville de Guerrara qui possède
un grand potentiel humain et culturel.
C'est dans ce cadre que s'inscrit la mission du comité de formation continue avec
son nouveau-né "Guerrara santé" dont l'objectif n'est que de satisfaire les besoins
d'apprendre et avoir plus d'ouverture sur le monde du savoir.
Monsieur le directeur de l'EPH de Guerrara
Mr. Hamadi. Hocine

Revue de la littérature : Myélome multiple
Pédiatrie: La Mort subite
P
Gynécologie: Prééclampsie
Le dossier : Cancer du sein
Activités hospitalières-
Evènements
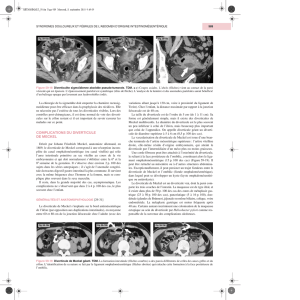
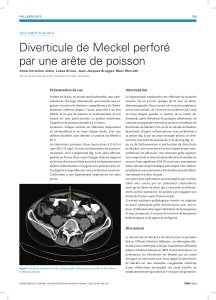
Cas Clinique: Diverticule de Meckel
Technique : Les blocs périphériques des
émoignant de la grande disparité des
situations, des moyens et des priorités en matière de
santé de par le monde, certains n’ont rien ou pas grande
chose. D’autres ont tout, mais pas assez… En effet,
offrir à chacun ce que la science peut fournir de plus
exceptionnel, demande un esprit de coopération, un peu
de philanthropie, un sens critique et beaucoup d’énergie
de la part de tous ceux qui se sont investis dans cette
action et qui doivent sans cesse parer au plus pressé et
s’attaquer à l’essentiel.
De façon plus prosaïque, en ce début d’année 2012 ;
l’équipe du comité de formation continue tente de faire
profiter encore une fois de sa motivation en inscrivant
une nouvelle naissance «GUERRARA SANTE », la revue
médico-chirurgicale de l’EPH Guerrara, qui essayera de
vous mettre au chevet de la communauté savante, vous
mettra au courant des nouveautés scientifiques ; un
parcours lumineux parsemé de revues de la littérature
internationales tout en prenant soins de vos exigences
sur le plan information médicale.
L’ensemble de l’équipe du CFC est ouvert à tous vos
critiques et suggestions pour le seul but commun:
promouvoir la santé dans notre pays…
Président du comité de formation continue
Dr DAHIA Med Elarbi
Éditorial
Au Sommaire
Au service
de la santé
T
T
Conduite à tenir: Polytraumatisme
Comité de rédaction
Dr. DAHIA Mohammed El-Arbi;
spécialiste en chirurgie générale
Dr. AOUADI Abdelaziz ;
Médecin généraliste
Dr. LARBI-BOUAMRANE
Ridha; Médecin généraliste
Comité scientifique :
Dr. DAHIA Mohammed El-Arbi; spécialiste en chirurgie générale;
président du comité scientifique et de la formation médicale continue;
Mr. RAMDANI Ali ; secrétaire général du comité scientifique et de la
formation médicale continue;
Dr. BAMOUN Bachir; spécialiste en chirurgie générale; président du
conseil médical ;
Dr. AMEUR Zohra; Médecin Interniste; chef de service de Médecine
interne;
Dr. RAMDANI Moussa; Médecin Chef de service de pédiatrie;
Dr. MERABET Mohammed; Médecin Chef de service des
Urgences;
Dr. LARBI-BOUAMRANE Ridha; Médecin généraliste; service de
maternité;
Dr. AOUADI Abdelaziz ; Médecin généraliste; service de Médecine
interne;
Mr. KHEDIM Mammar; Chef d'unité d'anesthésie réanimation
Mise au point :
Conception logo écotype: Dr. LARBI BOUAMRANE Ridha / Mise en page : Dr. LARBI BOUAMRANE R. et Dr. DAHIA M.E.A.
P.
P.
P.
P.
P.
P.
P.
P.
P.
P.

ةمسن

GUERRARA Santé
[Conduite à tenir: Avril ]
Le polytraumatisme: conduite à tenir
Dr. MERABET M. Médecin urgentiste; Service UMC; EPH Guerrara
En Réanimation
Ce qu'il faut retenir :
Sédation Analgésie des patients
Ventilation Artificielle
Stabilité hémodynamique
Nutrition
Antibiothérapie
Anticoagulation
Prévention des hémorragies de
Stress
Introduction- Définitions
80 % des polytraumatisés ont une lésion
orthopédique dont près d'un quart
présenterait une atteinte vertébrale.
Les 2/3 d'entre eux ont un traumatisme
crânien.
Association peu fréquente d'une urgence
hémodynamique et neurochirurgicale.
Patient atteint de deux lésions ou plus,
dont une au moins menace le pronostic
vital.
Tout traumatisé grave est considérée
comme Traumatisé du Rachis jusqu’à
preuve du contraire.
Mécanisme Du Polytraumatisme:
AVP, Accident de la circulation, Chute,
Accident de travail, Lésion par arme,
Blanche ou arme à Feu,
décélération brutale, une rupture aortique
possible sera évoquée.
Conduite à tenir:
Prise en charge Pré-hospitalière
* Sur les lieux de l’accident: Secours
primaires médicalisés: Notion de "Golden
Hour":
Protéger, Alerter, Secourir par les
passants;
Arrivée du SAMU ou de la Protection
Civile;
Désincarcération du blessé;
Ramassage et Relevage du blessé;
Axe tête-cou-tronc doit être respecté;
Installation du blessé dans le matelas
coquille;
Mise en place du collier cervical.
* Pendant le transport
Mise en condition et surveillance
*A l’accueil des Urgences
- Réanimation Initiale
- Prise en charge pluridisciplinaire
- Diagnostic et Traitement des différentes
Détresses: Ventilatoire; Circulatoire et
Neurologique.
Principales causes de détresse circulatoire
et respiratoire
Hypovolémie, hémorragie;
Pneumothorax suffocant;
Obstruction des VAS : corps étranger,
fracture du pharynx;
Pneumothorax ou hémo-pneumothorax;
Traumatisme pariétal étendu;
Principales causes de détresse circulatoire:
L'hypovolémie (hémorragie):
- Assurer l'hémostase;
- Voies veineuses périphériques et/ou
centrale (fémorale);
- Remplissage vasculaire (SSI; Ringer,
colloïdes, sang, autotransfusion);
- Inotropes positifs,
- Pantalon antichoc;
- Surveillance (pouls, PA, diurèse)
Principales causes de détresse respiratoire:
L' hypoxie:
- Désobstruction des VAS,
- Oxygénation avec masque,
- Intubation,
- Drainage thoracique,
- Ventilation,
- Surveillance (spo2, capnographie).
- Indications de l’intubation trachéale:
- ,
- États de choc: une PAS < à 90 mmHg
sous traitement optimal,
- Obstruction des VAS,
-
sédation,
- Hypoxie,
- Arrêt cardiorespiratoire,
Prise en charge Hospitalière:
Plateau Technique
Notion de Trauma Center
Nécessite une prise en charge
pluridisciplinaire à savoir: Anesthésiste,
Chirurgiens (Neuro, Thorax, Vasculaire),
Radiologie (Echo, Angio, TDM, IRM; ETO,
Fibroscopie), Radiologie Interventionnelle
L’admission à l’hôpital permettra de:
Traiter toute détresse vitale,
Monitorage du patient: PAS,
Bilan lésionnel chez un patient stabilisé
et monitoré,
Transfert Directe au bloc si Urgence
chirurgicale.
Conclusion de la phase primaire
Indications d’intervention en urgence:
- Hémopéritoine évolutif,
- Hémopéricarde avec signes de
tamponnade, hémothorax volume
supérieur à 1500ml),
- Plaie vasculaire extériorisée (cervicale
ou des membres),
- Hématome intracrânien en particulier
extradural (avec effet de masse),
-
critères précoces),
- Embolisation après Angiographie.
Évaluation et diagnostics secondaires
Transfert du patient en USI; Classification
des lésions (Injury Severity Score)
Examen Clinique
Scalp, Auscultation, sensibilité,
déformation, tonus anal
Bilan biologique
- Groupe sanguin, RAI
- Numération sanguine et plaquettes,
hémostase
- Gaz du sang
- Ionogramme sanguin, urée,
créatinine troponine
- Bilan Toxicologique: Alcool, Drogues,
BZD
Bilan anatomique
- Radiographie de thorax (face)
- Radiographie de rachis cervical,
dorsal et lombaire
- Radiographie de bassin
- ECG, Echographie multimodal
- Scanner Cérébral, Scanner Cervical,
Scanner Thoracique
- Réanimation Respiratoire
Oxygénothérapie
Intubation Trachéale:
tête-cou-tronc est assurée par un aide,
Ventilation Mécanique: Elle doit éviter les
pression expiratoire positive (PEP) ne
permet pas de prévenir les insuffisances
respiratoires post-traumatiques. Un
volume courant compris entre 7 et 12
ml/kg et une fréquence respiratoire
comprise entre 12 et 16
Drainage pleurale
Algorithme décisionnel concernant
du patient
présentant un traumatisme grave.
Conclusion
Devant l'ampleur des accidents de la
circulation où le polytraumatisé
représente l'urgence par excellence ; la
prise en charge doit être pluridisciplinaire
nécessitant ainsi un support logistique
adéquat, une vraie réflexion sur la prise en
charge actuelle du traumatisé grave
pourra promouvoir nos façons d'agir face
à ce fléau.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%