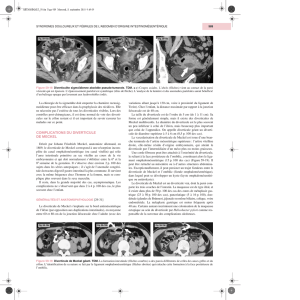
Les aspects pathologiques du diverticule de Meckel chez l`enfant

Journal
de
pédiatrie
et
de
puériculture
(2013)
26,
146—150
Disponible
en
ligne
sur
www.sciencedirect.com
ARTICLE
ORIGINAL
Les
aspects
pathologiques
du
diverticule
de
Meckel
chez
l’enfant
Pathologic
aspects
of
Meckel’s
diverticulum
in
children
R.
Khemekhema,∗,
Y.
Ben
Ahmeda,
H.
Rahaya,
G.
Soufianea,
J.
Saida,
W.
Douirab,
B.
Ibtisemb,
C.
Béjia
aService
de
chirurgie
pédiatrique
«
B
»,
faculté
de
médecine
de
Tunis,
université
de
Tunis
El
Manar,
hôpital
d’Enfant
de
Tunis,
place
Bab-Saadoun,
1007
Tunis,
Tunisie
bService
de
radiologie
pédiatrique,
Tunis,
Tunisie
Rec¸u
le
4
juin
2012
;
accepté
le
25
f´
evrier
2013
MOTS
CLÉS
Diverticule
de
Meckel
;
Hémorragie
digestive
;
Diverticulite
;
Occlusion
intestinale
aiguë
;
Enfant
Résumé
Quoi
que
rare,
le
diverticule
de
Meckel
(DM)
reste
l’anomalie
congénitale
la
plus
fréquente
de
l’intestin
grêle.
Le
plus
souvent
latent,
mais
peut
être
la
cause
de
complications
diverses
qui
constituent
autant
de
circonstances
de
diagnostic.
But.
—
Préciser
les
aspects
cliniques,
radiologiques
et
les
indications
thérapeutiques
devant
un
DM
chez
l’enfant.
Patients
et
méthodes.
—
Nous
rapportons
une
série
de
40
enfants
traités
dans
notre
institution
sur
une
période
de
11
ans
allant
du
1er janvier
2001
au
30
décembre
2011.
Résultats.
—
Il
s’agit
de
40
patients
répartis
en
32
garc¸ons
et
huit
filles,
âgés
de
un
jour
à
15
ans
avec
une
moyenne
de
30
mois.
Les
circonstances
de
diagnostic
étaient
un
syndrome
occlusif
dans
15
cas,
une
invagination
intestinale
aiguë
dans
12
cas,
une
hémorragie
digestive
dans
sept
cas
et
une
découverte
fortuite
dans
six
cas.
Le
diagnostic
radiologique
était
basé
sur
le
couple
ASP
et
échographie
abdominale
qui
ont
permis
d’évoquer
le
diagnostic
dans
22
cas.
La
scintigraphie
au
Tech
99mréalisée
devant
une
hémorragie
basse
dans
six
cas
a
permis
le
diagnostic
positif
de
DM
dans
cinq
cas.
Tous
ces
enfants
ont
été
opérés
(en
urgence
dans
28
cas
et
à
froid
dans
12
cas)
et
ont
bénéficié
d’une
résection
du
diverticule
avec
anastomose
iléo-iléale
en
un
temps
dans
38
cas
et
une
double
iléostomie
première
suivit
d’un
rétablissement
secondaire
de
la
continuité
digestive
du
fait
de
l’existence
d’une
péritonite
avancée
dans
deux
cas.
∗Auteur
correspondant.
Adresse
e-mail
:
(R.
Khemekhem).
0987-7983/$
—
see
front
matter
©
2013
Publié
par
Elsevier
Masson
SAS.
http://dx.doi.org/10.1016/j.jpp.2013.02.001

Les
aspects
pathologiques
du
diverticule
de
Meckel
chez
l’enfant
147
L’évolution
a
été
favorable
dans
tous
les
cas
sauf
un
patient
qui
a
succombé
à
un
état
de
choc
septique
secondaire
à
une
péritonite
diverticulaire.
Conclusion.
—
La
diversité
des
modes
de
révélation
du
DM
rend
son
diagnostic
parfois
difficile.
Il
faut
toutefois
y
penser
devant
tout
syndrome
occlusif
fébrile,
une
invagination
intestinale
aiguë,
ou
une
hémorragie
digestive
basse.
Le
traitement
étant
chirurgical.
©
2013
Publié
par
Elsevier
Masson
SAS.
KEYWORDS
Meckel’s
diverticulum;
Gastro-intestinal
bleeding;
Diverticulitis;
Acute
intestinal
obstruction;
Intussusception;
Child
Summary
Anything
unusual,
Meckel’s
diverticulum
is
the
most
common
congenital
abnorma-
lity
of
the
small
intestine.
Most
often
latent,
but
can
cause
complications
that
are
all
different
circumstances
of
diagnosis.
Purpose.
—
To
specify
the
clinical,
radiological
findings
and
therapeutic
indications
of
the
Meckel’s
diverticulum
in
children.
Patients
and
methods.
—
We
report
a
series
of
40
children
treated
at
our
institution
over
a
period
of
11
years
from
1st
January
2001
to
30
December
2011.
Results.
—
These
40
patients
divided
into
32
boys
and
eight
girls,
aged
1
day
to
15
years
with
an
average
of
30
months.
The
circumstances
of
diagnosis
were
intestinal
obstruction
in
15
cases,
an
acute
intestinal
intussusception
in
12
cases,
gastro-intestinal
bleeding
in
seven
cases
and
a
chance
discovery
in
six
cases.
Radiological
diagnosis
was
based
on
the
couple
ASP
and
abdominal
ultrasound
that
have
allowed
discussion
of
diagnosis
in
22
cases.
Techn
99m
scintigraphy
performed
in
six
cases
of
low
bleeding
make
the
positive
diagnosis
of
MD
in
five
cases.
All
these
children
underwent
surgery
(emergency
in
28
cases
and
elective
in
12
cases),
and
have
benefited
from
a
diverticulum
resection
with
ileo-ileal
anastomosis
in
one
time
in
38
cases,
and
a
double
ileostomy
followed
by
a
secondary
intestinal
anastomosis
in
two
cases
due
to
the
existence
of
advanced
peritonitis.
The
outcome
was
favorable
in
all
cases
except
one
patient
who
died
from
septic
shock
secondary
to
peritonitis.
Conclusion.
—
The
diversity
of
revelation
modes
of
Meckel’s
diverticulum
makes
its
diagnosis
difficult.
However,
it
should
think
about
before
any
feverish
occlusive
syndrome,
an
acute
intestinal
intussusception
or
lower
gastro-intestinal
bleeding.
The
treatment
is
surgical.
©
2013
Published
by
Elsevier
Masson
SAS.
Introduction
Le
diverticule
de
Meckel
(DM)
est
dû
à
la
persistance
par-
tielle
du
canal
omphalo-mésentérique
(COM).
Ce
dernier
fait
communiquer
pendant
la
vie
intra-utérine,
l’intestin
primitif
avec
la
vésicule
ombilicale
avant
de
disparaître
totalement
à
partir
de
la
cinquième
semaine
de
gestation.
Il
s’agit
d’une
anomalie
rare
puisque
seuls
2
%
des
indivi-
dus
en
sont
porteurs.
Le
DM
est
généralement
latent,
mais
peut
aussi
être
res-
ponsable
de
complications
diverses
qui
constituent
autant
de
circonstances
de
diagnostic
:
occlusion
intestinale
aiguë,
invagination,
hémorragie
digestive,
infection
(diverticu-
lite),
perforation.
.
.
Ces
complications
sont
fréquentes
chez
l’enfant,
d’autant
plus
qu’il
est
jeune.
Patients
et
méthodes
Il
s’agit
d’une
étude
rétrospective
menée
au
service
de
chi-
rurgie
pédiatrique
«
B
»
de
l’hôpital
Béchir
Hamza
de
Tunis
sur
une
période
de
11
ans
(janvier
2001—décembre
2011).
Quarante
enfants
dont
32
garc¸ons
et
huit
filles
ont
été
pris
en
charge
pendant
cette
période,
soit
en
urgence,
soit
à
froid.
L’âge
de
ces
enfants
varie
de
un
jour
à
15
ans
avec
une
moyenne
d’âge
de
30
mois.
Sur
le
plan
clinique,
les
circonstances
de
diagnostic
ont
été
un
syndrome
occlusif
dans
15
cas,
une
invagination
intestinale
aiguë
dans
12
cas
dont
cinq
avec
des
signes
péri-
tonéaux
et
une
hémorragie
digestive
isolée
dans
sept
cas.
La
découverte
a
été
faite
de
fac¸on
fortuite
dans
six
cas.
Tous
ces
patients
ont
bénéficié
d’un
abdomen
sans
pré-
paration
qui
a
montré
des
niveaux
hydro-aériques
de
type
grêle
dans
18
cas,
et
d’une
échographie
abdominale
qui
a
suspecté
le
diagnostic
de
DM
dans
22
cas
(soit
55
%).
La
scintigraphie
au
Tc99
ou
aux
globules
rouges
marqués
a
été
réalisée
dans
six
cas
révélés
par
une
hémorragie
diges-
tive
et
a
suspecté
le
diagnostic
de
DM
dans
cinq
cas.
Tous
les
patients
ont
été
opérés,
en
urgence
dans
28
cas
et
à
froid
dans
12
cas.
Le
diverticule
était
macroscopique-
ment
sain
dans
14
cas,
d’aspect
inflammatoire
avec
des
signes
de
diverticulite
dans
16
cas,
et
nécrotique
dans
dix
cas.
Il
a
été
réalisé
une
résection
du
diverticule
avec
ana-
stomose
grélo-grélique
termino-terminale
dans
38
cas
et
une
double
iléostomie
première
à
cause
d’une
péritonite
avancée
dans
deux
cas.
Le
rétablissement
de
la
continuité
digestive
a
été
réalisé
un
mois
plus
tard.
L’évolution
a
été
marquée
par
la
survenue
d’une
fistule
anastomotique
dans

148
R.
Khemekhem
et
al.
un
cas
et
d’un
sepsis
sévère
compliqué
d’un
choc
septique
au
45ejour
postopératoire
ayant
aboutit
au
décès
dans
un
cas.
Les
suites
opératoires
étaient
simples
dans
les
cas
restants.
À
l’examen
anatomopathologique,
il
existe
une
hétéro-
topie
gastrique
dans
28
cas,
une
muqueuse
iléale
dans
dix
cas,
et
une
muqueuse
colique
dans
deux
cas.
Discussion
Fabricius
Hildanus,
un
chirurgien
allemand,
fut
le
premier
à
consigner
en
1598
ses
observations
sur
ce
qui
est
main-
tenant
connu
universellement
comme
le
DM
quand
il
a
décrit
un
«
diverticule
intestinal
inhabituel
».
Alexis
Littré
a
également
signalé
la
présence
d’un
diverticule
iléal
dans
une
hernie
inguinale
en
1700.
Et
c’est
Johann
Friedrich
Meckel,
qui
a
finalement
donné
son
nom
à
cette
anomalie,
après
l’avoir
décrit
en
1809
en
travaillant
comme
professeur
d’anatomie
à
l’université
de
Halle
[1,2].
Le
DM
est
l’anomalie
congénitale
la
plus
fréquente
de
l’intestin
grêle,
survenant
dans
environ
2
%
à
4
%
de
la
popu-
lation
avec
une
légère
prédominance
masculine.
Il
siège
généralement
sur
le
versant
antimésentérique
de
l’iléon
distal
dans
les
90
derniers
centimètres
de
la
valvule
iléo-
colique
dans
plus
de
90
%
des
cas.
Sa
vascularisation
est
assurée
par
une
branche
terminale
de
l’artère
mésentérique
supérieure,
reliquat
de
l’artère
vitelline
et
possède
un
méso
propre
[3].
La
longueur
moyenne
du
DM
est
de
trois
centimètres
;
90
%
des
diverticules
mesurent
entre
un
et
dix
centimètres.
Ils
sont
donc
le
plus
souvent
courts
et
trapus.
Le
DM
peut
être
le
siège
d’une
hétérotopie
muqueuse,
et
on
parle
de
muqueuse
ectopique.
Elle
est
le
plus
souvent
d’origine
gas-
trique
(dans
50
%
des
cas)
et
semble
être
un
facteur
de
risque
pour
les
complications
liées
au
diverticule
[4,5].
Le
DM
est
un
vestige
du
COM.
Au
cours
du
développe-
ment
précoce
du
fœtus,
l’intestin
moyen
est
relié
à
l’ombilic
par
le
canal
vitellin
à
fin
d’assurer
la
nutrition
fœtale.
Avec
la
fermeture
de
la
paroi
abdominale,
l’orifice
ombilical
se
rétrécit
et
l’anse
intestinale
primitive
réintègre
la
cavité
abdominale,
et
le
canal
vitellin
s’oblitère
à
partir
de
la
septième
semaine
de
gestation.
En
l’absence
d’involution
totale,
plusieurs
situations
pathologiques
peuvent
être
ren-
contrées
:
la
non-involution
de
la
partie
la
plus
proximale
du
canal
aboutit
à
l’apparition
du
DM
qui
peut
être
relié
à
la
face
postérieure
de
l’ombilic
par
un
cordon
fibreux
(ligament
entéro-mésentérique)
retrouvé
dans
15
%
des
cas.
La
persistance
complète
aboutit
aux
fistules
omphalo-
mésentériques.
D’autres
anomalies
d’involution
peuvent
se
voir,
y
compris,
les
sinus
et
les
kystes
[3,5,6].
Le
DM
peut
rester
latent
pendant
longtemps
est
alors
découvert
de
fac¸on
fortuite
lors
d’une
laparotomie
(diver-
ticule
de
rencontre).
Il
peut
aussi
être
à
l’origine
de
complications
dont
le
risque
de
survenue
est
estimé
à
environ
4
%,
dont
40
%
surviennent
chez
les
enfants
préfé-
rentiellement
de
sexe
masculin
avec
un
sex-ratio
allant
de
3/1
à
8/1)
[5—7].
Chez
l’enfant,
le
mode
de
révélation
est
le
plus
souvent
un
saignement
gastro-intestinal
à
partir
d’une
muqueuse
ectopique.
C’est
la
complication
la
plus
fréquente
chez
l’enfant
avant
deux
ans
alors
qu’elle
ne
représente
que
la
troisième
cause
de
complication
chez
l’adulte.
Dans
notre
série,
ce
mode
de
révélation
n’a
été
rencontré
que
dans
17,5
%
des
cas
du
fait
que
celle-ci
comporte
un
pourcentage
élevé
de
grands
enfants
(âge
moyen
30
mois).
Il
s’agit
le
plus
souvent
d’une
hémorragie
digestive
basse,
à
type
de
melæna
ou
de
rectorragies
parfois
importantes.
En
effet,
le
DM
est
le
siège
d’une
hétérotopie
gastrique
dans
près
de
50
à
80
%
des
cas
(muqueuse
identique
à
celle
de
l’estomac)
et
sécrète
alors
de
l’acide
chlorhydrique
qui
peut
entraîner
une
ulcération
voire
une
perforation
de
la
muqueuse
intestinale
de
voisinage,
par
l’effet
de
cet
acide
sur
une
muqueuse
non
habituée
à
un
tel
traitement
[5].
Devant
une
hémorragie
digestive
avec
coloscopie
et
fibroscopie
esogastroduodénale
normales,
on
doit
évoquer
un
saignement
à
partir
de
l’intestin
grêle.
Le
DM,
les
ectasies
vasculaires,
les
tumeurs
de
la
grêle,
notamment
stromales
et
les
pathologies
ulcéreuses
constituent
dans
ce
cas
les
différentes
étiologies
à
évoquer.
Le
DM
peut
aussi
être
le
siège
d’une
hétérotopie
pan-
créatique
qui
est
identifié
dans
environ
5
%
des
diverticules
;
moins
souvent,
ils
peuvent
inclure
une
muqueuse
colique
ou
duodénale
[5,8,9].
Les
complications
occlusives
du
DM
sont
de
mécanismes
variables
[10,11].
Le
DM
peut
constituer
le
point
de
départ
à
une
invagi-
nation
intestinale
aiguë
qui
est
alors
de
type
iléo-iléale,
elle
serait
favorisée
par
un
diverticule
court
à
base
d’implantation
large
et
par
l’inflammation
(diverticulite).
Un
DM
peut
provoquer
une
obstruction
de
l’intestin
grêle
par
volvulus
autours
d’une
bride
omphalo-diverticulaire,
ou
par
incarcération
dans
le
méso
diverticule
contenant
l’artère
vitelline.
Il
peut
aussi
s’incarcérer
et
s’étrangler
dans
une
hernie
inguinale.
Des
cas
de
dégénérescences
malignes
sur
DM
ont
été
décrits
chez
l’adulte
[9,10].
Les
diverticulites
ne
sont
pas
rares,
et
sont
consécutives
à
une
stase
du
contenu
liquidien
avec
pullulation
micro-
bienne.
Le
rôle
d’une
infection
à
Helicobacter
pylori
de
la
muqueuse
gastrique
ectopique
ou
d’un
corps
étranger
dans
la
lumière
diverticulaire
a
été
incriminé
[3,11].
Le
DM
est
généralement
une
malformation
isolée
et
la
localisation
de
celui-ci
dans
le
cordon
ombilical
est
rare
mais
expose
à
une
autre
complication
résultant
de
la
mise
en
place
incorrecte
de
pinces
de
clampage
du
cordon
ombi-
lical
à
la
naissance
incorporant
une
petite
omphalocèle
ou
hernie
dans
le
cordon
(un
cas
de
DM
associé
à
une
ompha-
locèle
dans
notre
série).
Il
s’agit
d’un
risque
potentiel
mais
rare
de
clampage
de
l’intestin
au
moment
de
la
manipula-
tion
de
l’ombilic.
Tout
épaississement
inhabituel
de
la
base
du
cordon
ombilical,
devrait
alerter
sur
la
possibilité
de
l’existence
d’anomalie
potentielle.
Dans
ces
cas,
le
cordon
doit
être
serré
à
une
distance
suffisante
et
une
consultation
de
chirurgie
pédiatrique
est
alors
envisagée.
Obstétriciens,
pédiatres,
infirmières
et
sages-femmes
qui,
habituellement
serrent,
manipulent
le
cordon
en
salle
d’accouchement
ou
à
l’arrivée
dans
la
pépinière
doivent
être
conscient
de
ces
anomalies
potentielles
du
tube
digestif
[5].
Le
diagnostic
des
formes
asymptomatiques
de
DM
est
difficile.
Cette
anomalie
doit
être
recherchée
chaque
fois
qu’une
laparotomie
est
réalisée.
De
même,
en
cas
de
douleurs
abdominales
inexpliquées,
de
nausée,
de
vomis-
sements
et
surtout
devant
une
hémorragie
digestive,
le
diagnostic
de
DM
doit
être
à
l’esprit.
En
effet,
le
tableau
cli-
nique
peut
prêter
à
confusion
avec
nombreuses
pathologies

Les
aspects
pathologiques
du
diverticule
de
Meckel
chez
l’enfant
149
comme
un
ulcère
peptique,
une
gastro-entérite,
des
coliques
hépatiques.
Mais
surtout,
le
diagnostic
préopéra-
toire
le
plus
fréquemment
évoqué
est
celui
de
l’appendicite
aiguë
[5,11].
En
cas
d’invagination
intestinale
aiguë
sur-
venant
chez
un
enfant
de
plus
de
deux
ans,
une
cause
organique
doit
être
recherchée
dont
la
plus
fréquente
étant
le
DM.
Le
diagnostic
radiologique
du
DM
faisait
classiquement
appel
à
l’opacification
de
la
grêle
(de
préférence
par
entéroclyse),
rarement
à
l’angiographie
dans
les
formes
hémorragiques
ou
non
en
montant
les
artères
vitellines
embryonnaires
[11].
Ces
explorations
ne
font
plus
partie
de
nos
jours
du
bilan
de
DM.
La
radiographie
de
l’abdomen
sans
préparation
n’est
habituellement
pas
utile
pour
faire
le
diagnostic
d’un
DM.
Elle
peut
être
normale
ou
montrer
des
signes
non
spéci-
fiques,
tels
qu’une
obstruction
de
l’intestin
grêle,
ou
un
pneumopéritoine
signant
une
perforation,
rarement
une
entérolithiase
peut
être
identifiée
[4].
Les
aspects
échographiques
du
DM
varient
en
fonc-
tion
de
l’apparition
de
complications.
En
l’absence
de
complications,
le
DM
apparaît
comme
une
structure
diges-
tive
borgne
en
cible
péri-ombilicale
qui
prête
à
confusion
avec
un
appendice.
En
cas
de
diverticulite,
sa
paroi
devient
épaisse
et
peut
contenir
un
entérolithe.
Un
DM
enflammé
peut
également
ressembler
en
échographie
à
une
duplica-
tion
kystique,
qu’on
retrouve
couramment
dans
la
région
de
l’iléon
terminal.
Ces
deux
conditions
peuvent
être
distin-
guées
par
l’aspect
plus
irrégulier
de
la
muqueuse
en
cas
de
DM
et
l’aspect
caractéristique
de
double
paroi
dans
la
dupli-
cation
kystique.
D’autres
aspects
ont
été
décrits,
tel
qu’une
masse
kystique
compressible,
à
paroi
épaisse
et
irrégulière,
qui
peut
être
en
forme
de
goutte,
de
forme
tubulaire
allon-
gée
voir
sacculaire.
Dans
les
cas
où
l’invagination
est
secondaire
à
un
DM
inversé
l’aspect
est
celui
d’une
masse
en
cible
avec
une
zone
centrale
hyperéchogène,
décrit
également
comme
un
signe
de
double
cible.
L’identification
d’un
DM
au
cours
des
lavements
effectués
pour
la
réduction
de
l’invagination
a
également
été
décrite.
Toutefois,
il
est
difficile
de
reconnaître
avec
certitude
un
DM
sur
un
lavement
et
aussi
de
le
différencier
d’une
autre
cause
organique
d’invagination
secondaire.
Une
masse
triangulaire
ou
en
forme
de
bulbe
a
été
suggéré
comme
un
signe
qui
est
plus
évocateur
d’un
DM
inversé
que
de
tout
autre
point
de
départ
pathologique.
La
scintigraphie
au
perthechnétate
de
technecium
(Tc99m)
est
considérée
par
plusieurs
auteurs
comme
la
technique
de
choix
pour
la
recherche
d’un
DM
notamment
chez
l’enfant
en
période
hémorragique.
C’est
un
examen
peu
invasif
et
suffisamment
performant,
cependant,
il
n’est
positif
qu’en
cas
d’hétérotopie
de
muqueuse
gastrique
[5,7].
Dans
la
scintigraphie
au
pertechnétate
de
technétium-
99m,
l’isotope
est
injecté
par
voie
intraveineuse
et
au
fil
du
temps,
il
s’accumule
dans
la
muqueuse
gastrique.
Le
DM
possédant
un
revêtement
glandulaire
gastrique
concentre
le
Tc99m
de
manière
identique.
Il
se
traduit
alors
par
un
foyer
fixant
le
technétium
qui
apparaît
au
même
temps
que
l’estomac
et
siège
habituellement
en
projection
de
la
région
péri-ombilicale
ou
supravésicale.
Son
caractère
immobile
et
son
intensité
croissante
au
cours
du
temps
sont
deux
caractéristiques
essentielles
permettant
de
le
distinguer
des
fixations
urinaires
et
digestives.
Chez
le
nourrisson
et
le
petit
enfant,
cet
examen
a
une
sensibilité
de
85
%
et
une
spécificité
de
95
%,
mais
qui
diminue
avec
l’âge
et
chez
les
adultes,
la
sensibilité
tombe
à
62,5
%
et
la
spécificité
n’est
que
de
seulement
9
%
[5,7].
Pour
augmenter
la
sensibilité
de
cet
examen,
certains
auteurs
préconisent
l’utilisation
d’agents
pharmacologiques
qui
augmentent
la
fixation
du
Tech
99m
sur
la
muqueuse
gastrique
ou
diminuent
sa
sécré-
tion
dans
la
lumière
intestinale
[7].
Une
cœlioscopie
diagnostique
est
de
plus
en
plus
réalisée
en
cas
de
forte
suspicion
de
DM,
elle
permet
à
la
fois
le
diagnostic
mais
aussi
de
réaliser
la
résection
du
DM.
Le
traitement
du
DM
est
chirurgical
et
repose
sur
la
résec-
tion
d’un
court
segment
de
grêle
de
part
et
d’autre
de
la
base
d’implantation
du
diverticule
après
contrôle
vascu-
laire
suivit
d’une
anastomose
iélo-iléale
termino-terminale.
Dans
les
formes
compliquées
de
péritonite,
l’anastomose
doit
être
différée
de
quelques
semaines.
La
résection
losangique
est
une
autre
alternative
qui
sectionne
le
diverticule
en
laissant
en
place
sa
base
d’implantation
sur
l’intestin
grêle.
La
paroi
de
la
grêle
est
sectionnée
en
biais
en
s’arrêtant
à
distance
du
bord
mésen-
térique.
L’intestin
est
ensuite
fermé
par
des
points
séparés.
Cette
technique
plus
simple
et
plus
rapide
a
l’avantage
de
ne
pas
rompre
la
continuité
de
l’intestin
et
donc
des
suites
plus
simples
[12].
L’exérèse
du
diverticule
est
réalisée
par
laparotomie
ou
au
décours
d’une
laparoscopie
diagnostique,
soit
totale-
ment
(exérèse
intracorporelle),
soit
par
voie
mixte
(exérèse
extracorporelle)
[13].
S’il
est
acquis
que
le
DM
pathologique
doit
être
retiré
par
résection
anastomose,
certaines
questions
demeurent
encore
posées
:
faut-il
rechercher
systématiquement
le
DM
lors
d’une
intervention
abdominale,
faut-il
retirer
systéma-
tiquement
un
diverticule
rencontré
fortuitement
?
En
fonction
du
contexte,
on
pourra
soit
laisser
délibéré-
ment
en
place
le
diverticule,
en
prenant
soin
d’en
informer
le
patient
ou
ses
parents
s’il
s’agit
d’un
enfant,
soit
procéder
à
son
ablation
immédiate.
Conclusion
Quoi
que
rare,
le
DM
est
l’anomalie
la
plus
fréquente
de
l’intestin
grêle.
Il
se
voit
chez
2
%
des
individus
et
résulte
d’un
défaut
de
régression
du
COM.
Le
DM
peut
rester
longtemps
asymptomatique
mais
peut
donner
lieu
à
des
complications
dont
certaines
peuvent
mettre
en
jeu
le
pronostic
vital.
Ces
complications
sont
d’autant
plus
fréquentes
que
l’enfant
est
jeune
:
30
%
des
complications
surviennent
avant
un
an
et
dans
ces
cas,
il
s’agit
surtout
d’hémorragie.
Chez
le
grand
enfant,
il
s’agit
surtout
de
syndrome
occlusif
dont
les
étiologies
sont
diverses
:
invagination
intestinale
aiguë,
volvulus,
diverticu-
lite,
corps
étrangers
intraluminal.
La
scintigraphie
au
Tc99m
est
un
examen
performant
et
non
invasif
qui
permet
le
diagnostic
de
DM
hémorragique.
Les
autres
examens
radiologiques
sont
peu
contributifs
au
diagnostic
qui
est
parfois
une
découverte
opéra-
toire.
Le
traitement
repose
sur
la
résection
chirurgicale
qui
peut
être
réalisée
par
laparotomie
ou
par
laparoscopie.

150
R.
Khemekhem
et
al.
Si
l’indication
chirurgicale
est
facile
à
poser
dans
les
formes
compliquées,
elle
est
beaucoup
plus
difficile
à
prendre
dans
le
cas
de
DM
de
découverte
fortuite.
Dans
tous
les
cas,
le
risque
de
l’ablation
doit
être
mis
en
balance
avec
le
risque
de
l’abstention.
Références
[1]
Thurleya
PD,
Hallidaya
KE,
Somersa
JM,
Al-Darajib
WI,
Ilyasb
M,
Brodericka
NJ.
Radiological
features
of
Meckel’s
diverticulum
and
its
complications.
Clin
Radiol
2009;64:109—18.
[2]
Meckel
JF.
Uber
die
divertikel
am
darmkanal.
Arch
die
Physio
1809;9:421—53.
[3]
Zaghouani
Ben
Alaya
H,
Bakir
D,
Hammami
M,
Tilouch
S,
Kriaa
S,
Harzallah
L,
et
al.
Diverticulite
de
Meckel
chez
un
nourrisson.
Arch
Pediatr
2011;18:1001—3.
[4]
Galifet
M,
Michel
P.
Complications
occlusives
en
rela-
tion
avec
le
diverticule
de
Meckel.
Presse
Med
2009;38:
1009—22.
[5]
Martin
JP,
Connor
PD,
Charles
K.
Meckel’s
diverticulum.
Am
Fam
Phys
2000;61(4):1037—42.
[6]
Milbrandt
K,
Sigalet
D.
Intussusception
associated
with
a
Meckel’s
diverticulum
and
a
duplication
cyst.
J
Pediatr
Surg
2008;43:E21—3.
[7]
Ajmi
S,
Sahnoun
L,
Boujelbene
N,
Sriha
B,
Essabbah
H.
Hémor-
ragie
d’un
diverticule
de
Meckel
de
l’enfant
découvert
par
scintigraphie
au
Technétium
99m.
J
Chir
2005;142(4):244—6.
[8]
Yang
PF,
Chen
CY,
Yu
FJ,
Yang
SF,
Chen
YT,
Kao
LC,
et
al.
A
rare
complication
of
Meckel’s
diverticulum:
A
fistula
between
Meckel’s
diverticulum
and
the
appendi
x.
Asian
J
Surg
2012,
http://dx.doi.org/10.1016/j.asjsur.2012.04.018.
[9]
Wu
MH,
Wang
MY,
Tsai
HI,
Lin
MT.
A
loop
formation
of
Meckel’s
diverticulum
causes
intestine
ischemia.
Surgery
2008;143:693—4.
[10]
Sethi
NT,
Chauhan
A,
Tiwari
S.
Meckel’s
diverticulum
with
mesodiverticular
band:
an
unusual
presentation.
MJAFI
2009;65:75—6.
[11]
Barbary
C,
Tissier
S,
Floquet
M,
Régent
D.
Imagerie
des
complications
du
diverticule
de
Meckel.
J
Radiol
2004;85:273—9.
[12]
Grapin
C,
Bonnard
A,
Helardot
PG.
Chirurgie
du
diverticule
de
Meckel.
EMC-Chirurgie
2005;2:613—20.
[13]
Grapin
C,
Bonnard
A,
Helardot
PG.
Chirurgie
cœlioscopique
du
diverticule
de
Meckel.
Ann
chir
2006;131:222—3.
1
/
5
100%