cahier 42

Partie chimie
Chapitre 1L'air qui nous entoure : un mélange de gaz
1 Rappels sur les états physiques de la matière
2 La composition de l'air
! " #$
%# &'( ! )&) '*+,
&-+, .'
"! %#'
%#! &/! 0
'
" & #//'
1/$
3 Le dioxygène, "gaz vital"
2 /! & / '
Chapitre 2Le modèle particulaire de la matière
1 Approche historique
3! (
4
3 *3 56.
"678 !956:
'3; 5 6 ! !56 /
<! = !'(
66/'
" '
%663 ! '
" 6 9 /9!'
2 Représentation du modèle particulaire
! >
% 7 8?@9#
'
A 9! / !9! !
BLes molécules sont… :
Bextrêmement petites : microscopiquesBBB'
BInsécables* ! .
'.Indéformables'''* ! =/.
BSéparéesBvide
% !* diminue< 6Baugmente<.
" BidentiquesB''
++ '!'/+C<+!DD+DD+D+D'
-

E 6 9
%6 %6 %6&
36
es molécules/atomes sont
très proches et fortement
liées entre elles
#compact
et les cristaux sont ordonnés.
36
les molécules sont proches et
glissent les unes sur les
autres
%# est compact et
désordonné
36&
les molécules sont espacées, ont
des mouvements rapides et
rebondissent sur les objets
%#&dispersé et
désordonné
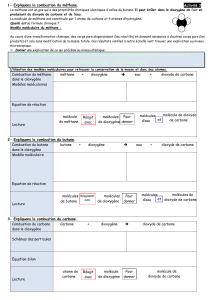
3 Modèle moléculaire de l'air
aReprésentation de l’air, l'air est un mélange
%# 4 fois
diazotedioxygène
-
82
12F
Chapitre 3Les propriétés physiques de l'air.
4&#&## '( #/'
1 L'air est un gaz, il est compressible
aLa pression d'un gaz
i"Le ballon qui se gonfle"
%9 */ /. /# # !
# 5# '
ii" le verre à l’envers."
E - -G+-
% 666 /6
6 H5 '
bMesure de la pression
I> I
@ = &! !
#9'
2 Interprétation microscopique de la pression
++ '!'/+C<+!DD+DD+D+D'
J6
Molécule de diazote
Molécule de dioxygène

aSimulation informatique d’un gaz : étude du modèle moléculaire d’un gaz.
! 1# &
2 &<!# '
@& / * 9 .
'*1 ! & .'
E ! &* 9 .
'*1 ! ! .'
"& / # &// #'%# *
&. //// #'
bUtilisation du modèle particulaire
! 2
2 &9! '
2 #9I I<5'
3 La "masse de l'air"
! IK&# $I
" #
# ! '
4
Conservation de la masse
%# # %#
Lorsque l'eau liquide se vaporise
## * !
/ .'
Lors d'un changement d'état physique le nombre total de
molécules ne change pas donc la masse totale
ne varie pas.
%l'on dissout un solide dans de l'eau
/
I I#'
Le nombre total de molécules ne change pas
donc la masse totale ne change pas'
3! # #'
'
@ 9 9 *'@//.'
"99 '
++ '!'/+C<+!DD+DD+D+D'
>#
*
9.
>#
*!#.
F,
-
F

L@9'
Chapitre 4Les combustions
1 Combustion du carbone
!,M
aSchéma
bObservations
iIl faut chauffer le carbone pour qu'il commence à brûler : dans l’air le carbone brûle faiblement.
iiLe carbone brûle faiblement dans l'air mais vivement dans le dioxygène pur.
iiiLa combustion finit par s’arrêter .Une allumette allumée s'éteint dans le flacon.
%9 9# '
cInterprétations
iLorsque l’on apporte suffisamment d'énergie le carbone réagit avec le dioxygène.
iiDans l’air, la combustion est faible car il n’y a que 20 % de dioxygène dans l’air.
iiiLa combustion s’arrête quand tout le dioxygène ou tout le carbone a disparu.
dQuels sont les réactifs de cette transformation chimique ?
"/ /
2 / 0 / '
%/9 9 *99. *9
.'
%9 ! /'
e Quels sont les produits?
"/
% 0 / '
*N%9 9 9 '.
! $!G
4%9
%9 !6 9 9 '
*7%69 9 '8.
(/ 6 9 9 9 '
aBilan de la réaction
@ 9
++ '!'/+C<+!DD+DD+D+D'
J!9 9
"
3O
9
99 9 6

P 9 9
4/
9 Q
*9 .
"
*9 . 9
J!9 L96
R Ile carbone ! le dioxygène pour du dioxyde de carbone"
4 ! 9 '
/
"
9 1 9
@9
R I%9 !6 9 'I
@
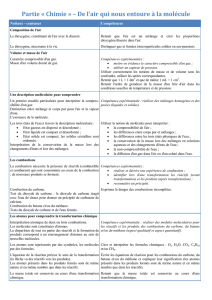
1 La combustion du méthane
aCF partie activité : combustion du méthane
%9 9 96 '
@!
%9 9
1-
bSchéma
cObservations et interprétations
%55&'
%/! 6 &9 '
%6 9 &'
9 9 '
%/ 9 '
% 9 6'
@
9P 9 '
36 '
II Modéliser les combustions grâce aux atomes
1 Représentation des atomes et des molécules
L69 * 6 !6
6// .'
9/ '
++ '!'/+C<+!DD+DD+D+D'
,
L5
& 6
3 &
L97S/S8
7S/S8
P
 6
6
 7
7
1
/
7
100%