Chap 6 : Réaction chimique

Chap 6 : Réaction chimique
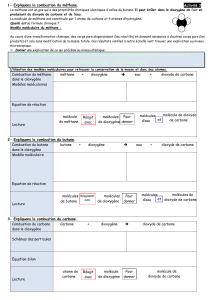
1) Combustion du carbone 2) Combustion du méthane

Dans cette transformation chaque atome de carbone
qui disparaît consomme une molécule de dioxygène
et fait apparaître une molécule de dioxyde de
carbone.
Ce bilan peut s’écrire en utilisant les formules des corps :
Cette écriture est appelée équation-bilan de la réaction
chimique.
Une réaction chimique est un réarrangement d’atomes .
Combustion du
carbone
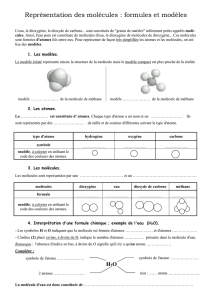
1) La combustion du carbone

2) la combustion du méthane
La combustion complète du méthane
consomme des molécules de méthane ainsi
que des molécules de dioxygène . La réaction
produit de l’eau et du dioxyde de carbone .
Modélisation de la réaction
Combustion du méthane

Pour donner des nombres entiers de
molécules , une molécule de méthane doit
réagir avec deux molécules de dioxygène ; il
se forme deux molécules d’eau et une
molécule de dioxyde de carbone .
Trouver ces proportions , c’est ce qu’on
appelle équilibrer une équation.
Modèle et combustion du méthane (delagrave)
Combustion du méthane

Dans une réaction chimique des molécules
réagissent entre elles pour donner de
nouvelles molécules avec les mêmes
atomes.
L’équation-bilan peut s’écrire :
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%