Gérard LERICHE Ecriture d`équations

Gérard LERICHE
Ecriture d'équations-bilans
de combustions avec le dioxygène
Dans le cadre du programme du cycle central, classe de 4ème, pour le chapitre :
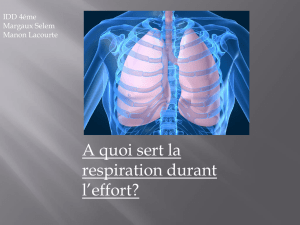
L'air qui nous entoure ; le dioxygène
_ Les atomes, un modèle pour comprendre la réaction chimique.
et pour atteindre l'objectif : " Savoir écrire les équations-bilans des combustion du carbone et du
méthane " il est suggéré d'utiliser des modèles moléculaires compacts ou de simulation.
Sans nier l'intérêt de ces techniques, on peut regretter le coût des modèles moléculaires, le caractère
peu pratique des assemblages, et la maintenance difficile. La mise en oeuvre des logiciels dépend du
niveau d'équipement informatique et/ou des conditions d'utilisation du CDI du collège.
Pour que les élèves s'impliquent dans cet exercice, en complément avec les méthodes précédentes, il
est possible d'utiliser des vignettes représentant chaque sorte de molécules mises en jeu.
Les élèves ont au préalable réalisé expérimentalement la combustion du carbone (fusain ou charbon de
sucre ...) et du méthane (ou butane, voir la fiche dans la boîte à outils) avec le dioxygène.
Ils ont constaté que les réactifs ont été consommés et que des produits, identifiés, se sont formés. La
comparaison de ces 2 combustions permet de préciser que les substances mises en jeu (sauf le
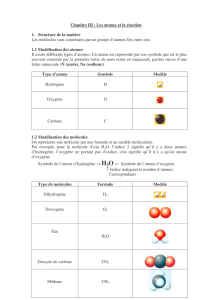
carbone) ont une structure moléculaire et que ces molécules sont constituées d'atomes.
A partir du principe de la conservation des atomes en nature et en nombre, la réaction chimique peut
être présentée comme un réarrangement d'atomes au sein de nouvelles molécules.
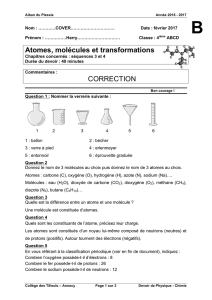
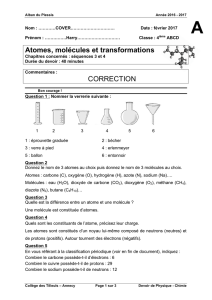
Une première écriture du bilan des réactions est proposée :
carbone + dioxygène ---> dioxyde de carbone
et
méthane + dioxygène ---> dioxyde de carbone + eau
( Cet exemple est préféré au butane pour sa simplicité, le cas du butane sera abordé un peu plus tard.)
Une deuxième étape est abordée en remplaçant les noms par les symboles des atomes (cas du
carbone) et les formules des molécules :
C + O2 ---> CO2 écriture qui ne pose pas de difficulté
et
CH4 + O2 ---> CO2 + H2O
le non-respect du principe de conservation des atomes apparaît clairement (cas de O et de H).
Après avoir indiqué qu'il n'est pas possible de modifier les formules, il faut amener les élèves à
proposer l'introduction de nombres, entiers, positifs, tels que x, y, z et w dans ce bilan :
x CH4 + y O2 ---> z CO2 + w H2O
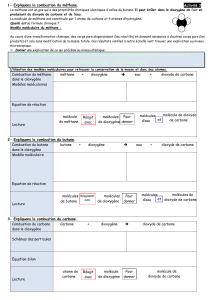
C'est alors que des "tas" de vignettes représentant les molécules de dioxygène, de dioxyde de carbone
et d'eau sont fournis aux élèves et disposés sur les tables. Puis distribuer, selon les groupes, x = 1 ou 2
ou 3 ou même 4 vignettes représentant les molécule de méthane CH4.
Chaque groupe doit puiser dans les "tas" z, w puis y vignettes représentant les molécules CO2, H2O et
O2 en veillant à avoir les mêmes nombres d'atomes C, H et O parmi les réactifs et les produits.
A la fin de cet exercice, 1 élève du groupe vient compléter au tableau l'écriture : CH4 + O2 ---> CO2 +
H2O en ajoutant ses valeurs de x, y, z et w .
Il est alors facile de vérifier que x = 1, y = 2, z = 1, et w = 2 est la solution la plus simple.
La présentation de modèles moléculaires et/ou d'un logiciel peut être alors introduite.
En graduant la difficulté, les élèves écrivent en utilisant les vignettes correspondantes, l'équation-bilan
de la combustion du propane C3H8, puis du butane C4H10, de l'éthanol C2H6O avec le dioxygène. Les
solutions sont rassemblées dans chaque cas au tableau, en les discutant.
Entre chaque exercice, les vignettes correspondant au combustible sont collectées pour éviter les
"mélanges" mais les "tas" ne sont récupérés qu'à la fin de l'ensemble des exercices.
Ces vignettes sont obtenues en photocopiant à environ 15 exemplaires les pages suivantes et en les
découpant avec un massicot puis elles sont classées dans des enveloppes ou des boîtes marquées.
Retour au sommaire "Chimie cycle central"

1
/
2
100%