CBR-4/1-94 (1er jour) N° 1 Coef. : EPREUVE FONDAMENTALE DE CHIMIE

1
CBR-4/1-94 (1er jour)
EPREUVE FONDAMENTALE DE CHIMIE
Durée : 6h SUJET N° 1 Coef. : 7
Toutes les calculatrices de poche, y compris les calculatrices programmables et
alphanumériques, dont la surface de base ne dépasse pas 21 cm de long et 15 cm de
large, sont autorisées à condition que leur fonctionnement soit autonome et qu’il ne
soit pas fait usage d’imprimantes.
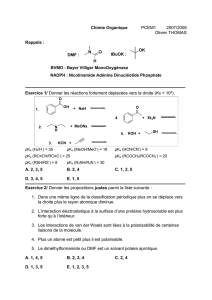
PREPARATION DU 1-PHENYLETHANOL
Le 1-phényléthanol est obtenu par réduction de la phényléthanone (acétophénone) par le
tétrahydruroborate de sodium NaBH4 (borohydrure de sodium) et par hydrolyse de l’alcoolate
intermédiaire.
I - Mode opératoire
I - 1 - Préparation
-Dans un réacteur de 250 mL équipé d’un réfrigérant, d’une ampoule de coulée, d’un
agitateur et d’un thermomètre, 2,2 g de tétrahydruroborate de sodium NaBH4 sont dissous
dans 45 mL d’éthanol.
-La phényléthanone (acétophénone) (20 g) est ajoutée goutte à goutte (le débit étant réglé de
façon à maintenir la température du milieu réactionnel au-dessous de 50°C). A la fin de
l’addition, le milieu réactionnel est agité 30 min à la température ambiante. Vérifier que la
réaction est terminée.
-Le composé intermédiaire formé est ensuite hydrolysé par addition de 90 mL d’eau.
-Le mélange réactionnel obtenu est transvasé dans une ampoule à décanter avec 40 mL de
dichlorométhane. Après séparation de la phase organique, la phase aqueuse est traitée par
deux fois 40 mL de dichlorométhane. Après quoi, le mélange des trois phases organiques
est lavé par quatre fractions de 20 mL d’eau jusqu’à pH neutre puis séché sur sulfate de
magnésium anhydre.
-Le dichlorométhane est ensuite évaporé. Mesurer le volume de produit brut.
-Le produit brut est ensuite distillé à la pression atmosphérique en prenant soin de bien
calorifuger la colonne Vigreux. Relever les températures de la phase gazeuse en fonction
du temps et effectuer les fractionnements jugés nécessaires.
-Recueillir le 1-phényléthanol dans un flacon taré. Peser.
I - 2 - Analyses
Le 1-phényléthanol est analysé par les moyens suivants:
-chromatographie en phase gazeuse.
-chromatographie sur couche mince : l’éluant est un mélange d’heptane et d’éthanoate
d’éthyle dans les proportions 92/8, la révélation est faite à l’UV.
-mesure de l’indice de réfraction.

2
II - Données
II - 1 - Sécurité
Phényléthanone (acétophénone) : liquide irritant.
Tétrahydruroborate de sodium NaBH4 (borohydrure de sodium): solide inflammable.
Ethanol: très inflammable.
Dichlorométhane : toxique.
II - 2 - Constantes physiques
solubilité
M (g mo1-1)t fus(0C) t eb(°C) d420 n420 eau éthanol
NaBH437,83 400 5 gL-1 s
acétophénone 120,14 19,65 202 1,0281 1,5363 j s
éthanol 46,07 -112,5 78,5 0,7893 1,3611 ts ts
CH2C1284,93 -97 40 1,3350 1,3348 ps ts
phényléthanol 122,17 195 1,0191 i ts
i : insoluble s: soluble ps : peu soluble ts: très soluble.
III - Compte rendu
1 -Effectuer la courbe de distillation températures de la phase gazeuse en fonction du
temps. Commenter.
2 -Présenter les résultats dans un tableau en distinguant la quantité et la qualité du
produit préparé.
3 -Commenter les deux chromatogrammes obtenus.
4 - Répondre aux questions suivantes :
1) Questions générales
a) Pourquoi ne pas avoir utilisé le tétrahydruroaluminate de lithium LiA1H4 pour
effectuer cette réduction cétone → alcool?
b) Dans quel milieu NaBH4 est-il stable?
c) Décrire le mécanisme de la réduction de la cétone par NaBH4 en solution aqueuse.
d) Ecrire l’équation de la réaction existant entre NaBH4 et H3O+. Quel est le risque
associé à la réaction ?

3
2) Questions sur la préparation
a) Donner les équations-bilan de chaque étape.
b) Que contient le milieu réactionnel à l’issue de:
- la première étape de la réaction.
- la deuxième étape de la réaction.
c) Pourquoi doit-on contrôler la température pendant l’addition de l’acétophénone?
d) Ecrire l’équation de réaction correspondant au test chimique permettant de contrôler la
fin de la réaction.
e) Quelle autre méthode permettrait de suivre le déroulement de la réaction?
f) Quel est le rôle joué par le dichlorométhane?
g) Qu’élimine-t-on par les lavages à l’eau?
h) Que contient la phase organique après les lavages?
3) Ouestions sur les réactifs et les produits
a) Calculer les quantités de matière (exprimées en moles).
b) Quelle est l’espèce limitante ? Justifier la réponse.
c) Quelle est la masse théorique de 1 -phényléthanol?
d) Exprimer et calculer le rendement.
4) Ouestions sur l’analyse
a) Il est difficile d’obtenir du l-phényléthanol chromatographiquement pur avec le
matériel de rectification courant. Le spectre IR du 1-phényléthanol obtenu peut
présenter une faible bande d’absorption vers 1700 cm1. Quelle en est la cause?
b) Comment débarrasser, par voie chimique, l’alcool de sa principale impureté? Ecrire la
réaction correspondante.
c) Interpréter le spectre IR ci joint (spectre 1) en identifiant les principales bandes
d’absorption. Justifier la bande de faible intensité à 3500 cm1.
d) Interpréter les spectres RMN ci-joints (spectres 2 et 3). Que se passe-t-il lors de
l’échange avec D2O?
e) Prévoir les 4 principaux pics des spectres de masse de l’acétophénone et du 1 -
phényléthanol . Les justifier.
1
/
3
100%