Lire l'article complet

Supplément à La Lettre de l’hépato-gastroentérologue - n° 4-5 - vol. VII - juillet-octobre 2004
93
Les œsophagites à éosinophiles de l’adulte :
pathologie émergente et trop souvent méconnue
N. Mathieu, Th. Vallot*
* CHU Bichat-Claude Bernard, Paris.
L’œsophagite à éosinophiles qui était
jusque-là décrite en association
avec les gastroentérites à éosinophiles,
est aujourd’hui considérée comme une
entité à part. Initialement rapportée chez
l’enfant, elle est de plus en plus souvent
observée chez l’adulte si l’on en juge
par l’abondance des publications qui lui
sont consacrées depuis ces trois dernières
années. Cette mise au point brève a
pour but de faire la synthèse des don-
nées sur cette entité dont la pathogénie
est encore largement ignorée.
Définition
L’œsophagite à éosinophiles est carac-
térisée par l’infiltration dense et diffuse
de l’épithélium œsophagien, par des
éosinophiles. Le nombre d’éosinophiles
intra-épithéliaux doit être supérieur à
15 ou 30 éléments par champ à fort gros-
sissement selon les auteurs (1). Il n’y a
pas dans cette forme d’atteinte gastrique
ou intestinale associée. L’infiltration éosi-
nophile est intense et diffuse ce qui la dis-
tingue des infiltrations à éosinophiles
secondaires au reflux qui sont modérées
(le nombre d’éosinophiles ne dépassant
pas 10-15 éléments par champ) et limi-
tées au bas œsophage (1).
Épidémiologie
L’œsophagite à éosinophiles de l’adulte
touche les sujets jeunes (moyenne d’âge
au moment du diagnostic entre 30 et
35 ans avec des extrêmes allant de 14 à
77 ans), de sexe masculin dans plus de
70 % des cas (2-6). Depuis le premier
cas rapporté par Attwood en 1993, plus
de 125 cas ont été publiés en quelques
années. Dans l’étude rétrospective de
Croese et al., le nombre de cas identi-
fiés dans une population urbaine de
198 000 habitants était passé de 0 avant
1995, à 12 cas entre 1995 et 2000, et à
19 cas entre 2001 et 2002 (6). Cette aug-
mentation de l’incidence peut n’être
qu’apparente et liée au fait qu’elle n’était
pas reconnue mais aussi à une exposi-
tion de plus en plus fréquente à la pol-
lution et à des facteurs allergiques
comme cela est constaté avec l’asthme
maladie qui lui est souvent associé (7).
Expressions cliniques
La dysphagie intermittente et l’impac-
tion alimentaire sont les deux symp-
tômes révélateurs. Le délai moyen entre
l’apparition des premiers symptômes et
le diagnostic est souvent long, compris
entre 3 et 4 ans selon les études (2-6),
avec des extrêmes pouvant aller jusqu’à
28 ans (5). Les troubles de la dégluti-
tion sont parfois plus frustes : simple
lenteur à prendre les repas pouvant chez
certaines adolescentes, conduire à évo-
quer le diagnostic d’anorexie mentale.
Cette dysphagie n’a que rarement de
retentissement sur l’état nutritionnel (3).
La dysphagie pourrait être secondaire
soit à un spasme induit par l’activation
des éosinophiles relarguant des média-
teurs de l’inflammation comme on
l’observe dans les bronches, soit à la
perte de l’élasticité de la paroi œsopha-
gienne avec altération de la propulsion
indépendamment de toute sténose (8),
soit enfin à une sténose fibrosante. Des
facteurs favorisants la dysphagie sont
mis en évidence dans 77 % des cas.
Pour Strauman et al., il s’agit surtout
de l’ingestion d’aliments solides secs
(viande, riz) (3).
Dans 30 % des cas environ, les malades
se plaignent de brûlures rétrosternales
d’autant plus évocatrices qu’elles n’ont
pas de caractère ascendant et surtout
qu’elles sont résistantes aux traitements
par les IPP (2-6).
Le diagnostic doit d’emblée être évo-
qué lorsque ces symptômes surviennent
chez des malades jeunes dans un contexte
personnel ou familial d’allergie notés
dans 30 à 50 % des cas (2-6).
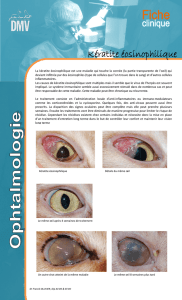
Aspects endoscopiques
Les anomalies endoscopiques sont par-
fois frustes mais certains aspects sont
évocateurs. L’aspect le plus typique est
celui de pseudo-trachée lié à la présence
de nombreux anneaux concentriques
mieux mis en évidence avec une insuf-
flation modérée (6). Cet aspect est très
différent de celui observé dans les œso-
phagites disséquantes qui réalisent des
diaphragmes muqueux étagés.
Le deuxième aspect caractéristique est
la présence de papules blanchâtres de
1-2 mm de diamètre arrangées en bou-
quet ou disséminées le long de l’œso-
phage, que l’on confond avec une can-
didose si l’on ne prend pas la précaution
de faire des biopsies. Ces “dépôts” cor-
respondent en fait à une infiltration
éosinophilique plus dense. La muqueuse
peut prendre un aspect granuleux, avec
non visualisation de réseau vasculaire.
La coloration à l’indigo carmin permet
de mieux objectiver l’existence de sillons
longitudinaux assez caractéristiques.
Dans plus de 50 % des cas des séries
Question d’actualité
Question d’actualité

94
Question d’actualité
Supplément à La Lettre de l’hépato-gastroentérologue - n° 4-5 - vol. VII - juillet-octobre 2004
Question d’actualité
publiées, il existe une sténose œsopha-
gienne. Elles sont rarement observées
chez l’enfant, ce qui suggère qu’elles
pourraient constituer une complication
évolutive d’une maladie qui aurait débuté
dans l’enfance. Le rétrécissement œso-
phagien peut être segmentaire sur une
longueur de 2 à 8 cm (5) ou concerner
toute la hauteur de l’œsophage réalisant
un œsophage étroit (9, 10). Lorsqu’elles
sont serrées (10 à 15 % des cas), elles
sont généralement proximales et faciles
à repérer endoscopiquement car infran-
chissables. Lorsqu’elles sont plus frustes,
elles peuvent ne pas être reconnues car
il n’y a pas de rupture de calibre et la
muqueuse qui les recouvre est normale,
sans aspect cicatriciel. Parfois ce n’est
que le constat, au retrait de l’appareil,
d’une déchirure muqueuse sur l’œso-
phage cervical provoquée par le passage
forcé de l’endoscope qui permet de sus-
pecter une anomalie. Cette fragilité par-
ticulière de la couche muqueuse qui se
déchire très facilement lors d’une tenta-
tive de passage en force ou des dilata-
tions est une caractéristique de ces œso-
phages (8). Bien que l’aspect puisse être
inquiétant, aucune perforation n’a été
rapportée. Dans 3 à 15 % l’endoscopie
est considérée comme normale (1).
Diagnostic
Le diagnostic n’est fait que sur les biop-
sies qui doivent s’imposer devant toute
dysphagie, même si l’aspect endosco-
pique de l’œsophage est normal et ce
d’autant plus qu’il s’agit d’un sujet jeune
et aux antécédents allergiques.
Les biopsies doivent être multiples et
étagées car l’infiltration éosinophilique
n’est pas homogène. Elles doivent être
réalisées au niveau des anomalies cons-
tatées avec en plus trois prélèvements au
niveau du tiers inférieur et surtout du
tiers supérieur afin d’éviter toute confu-
sion avec les infiltrations éosinophi-
liques liées au RGO (1). L’infiltration
prédomine plutôt au niveau du tiers
inférieur de l’œsophage (5). Il faut éga-
lement biopsier le fundus, l’antre et le
duodénum distal pour écarter toute
atteinte associée à ce niveau. Ces pré-
lèvements doivent être fixés dans une
solution de paraformaldéhyde à 4 % (3)
plutôt que dans une solution de Bouin
qui altère les éosinophiles. Les biopsies,
même superficielles, sont suffisantes pour
le diagnostic puisque l’infiltration par les
éosinophiles est intra-épithéliale.
Le diagnostic repose sur la présence d’au
moins 15-30 éosinophiles intra-épithé-
liaux par champ à fort grossissement (1).
L’anatomopathologiste doit aussi être
averti de la suspicion d’œsophagite à éosi-
nophiles afin qu’il puisse préciser dans
son compte-rendu le nombre et la distri-
bution des éosinophiles intra-épithéliaux,
la présence ou l’absence de micro-abcès
à éosinophiles (agrégats de plus de 4 éosi-
nophiles) (1, 2). L’absence d’infiltration
à éosinophiles dans l’estomac et le duo-
dénum permet d’éliminer les infiltrations
œsophagiennes secondaires à une exten-
sion des gastroentérites à éosinophiles.
Le transit œsophagien baryté peut aussi
être faussement interprété comme nor-
mal dès lors que le rétrécissement de
l’œsophage est diffus. Il est surtout utile
pour identifier les sténoses segmentaires
et afin de juger de l’indication d’un trai-
tement par dilatation. Certains proposent
d’utiliser des marshmallows imbibés de
baryte pour mieux apprécier l’expansion
de la lumière œsophagienne (10).
L’échoendoscopie n’a pour l’instant pas
d’intérêt pour le diagnostic. Un épais-
sissement des tuniques muqueuse et
musculeuse est parfois observé, confir-
mant l’atteinte musculaire dans cette
pathologie (1).
La manométrie œsophagienne n’apporte
pas d’élément discriminant. Les ano-
malies motrices rencontrées concernent
surtout le défaut de péristaltisme avec
parfois des ondes de fortes amplitudes
non propagées (1). Souvent elle est
normale.
Une hyperéosinophilie et un taux élevé
d’IgE sont retrouvés dans plus de la moi-
tié des cas, tout comme la positivité des
RAST (3, 6). Ces éléments ne sont pas
nécessaires au diagnostic, mais ils cons-
tituent un élément d’orientation et ont
une certaine valeur pronostique (3).
Diagnostic différentiel
L’infiltration à éosinophiles liés au reflux
est facilement éliminée sur les critères
histologiques et la diffusion des lésions.
En pratique, le diagnostic différentiel des
sténoses ne pose pas de difficulté dès lors
que le diagnostic est évoqué. Les autres
causes d’infiltration éosinophiliques
sont exceptionnelles (11).
Physiopathologie
La pathogénie de l’œsophagite à éosino-
philes reste obscure. L’inflammation au
cours des œsophagites à éosinophiles serait
la conséquence d’une réponse immunitaire
de type Th2 comparable à celle décrite dans
l’asthme. Il faut cependant expliquer pour-
quoi l’infiltration à éosinophiles se can-
tonne uniquement sur l’œsophage respec-
tant les autres segments du tube digestif.
Le fait que la moitié des malades ait une
pathologie allergique des voies aériennes
respiratoires conduit à suspecter l’exis-
tence d’une forte association entre les
réponses allergiques de l’œsophage et
des voies aériennes. Une étude expéri-
mentale chez la souris a pu reproduire
sélectivement cette infiltration à condition
d’introduire l’allergène par voie respiratoire
(12). Le fait qu’une diète élémentaire
puisse réduire l’infiltration éosinophilique
suggère que les allergènes introduits par
voie digestive pourraient aussi avoir une
certaine responsabilité. L’interleukine 5
jouerait un rôle prépondérant dans le chi-
miotactisme œsophagien et le déclenche-
ment de la cascade inflammatoire (13).
Le rôle de l’activation des éosinophiles
dans l’apparition des troubles de la motri-
cité et surtout dans la réaction fibrosante
de l’œsophage est encore largement
ignoré.
Traitement
Les traitements proposés sont ceux qui
ont déjà prouvé leur efficacité dans

Supplément à La Lettre de l’hépato-gastroentérologue - n° 4-5 - vol. VII - juillet-octobre 2004
95
l’asthme. Ils ont pour objectif de bloquer
la cascade des réactions, soit en diminuant
l’infiltration éosinophilique, soit en blo-
quant l’activation des éosinophiles, soit
enfin en bloquant l’action des médiateurs
libérés par l’activation des éosinophiles.
Chez l’enfant, l’éviction des allergènes
alimentaires s’est montrée efficace sur
les symptômes à condition de recourir
à des diètes élémentaires difficiles à
suivre sur des périodes prolongées (14,
15, 16). L’éviction des allergènes iden-
tifiés sur les tests allergiques ne semble
pas suffisante (16). Dans une étude chez
51 enfants, le délai moyen nécessaire
pour obtenir une amélioration des symp-
tômes était de 8,5 jours. Après un mois
de diète, l’infiltration éosinophilique
avait pratiquement disparue (14). Les
symptômes récidivaient après l’arrêt du
régime. L’intérêt de ces évictions n’est
pas démontré chez l’adulte et certains
ne les recommandent pas pour ces rai-
sons d’observance (6).
Les corticoïdes oraux ont été utilisés avec
succès chez les enfants intolérants au
régime d’exclusion ou ceux chez lesquels
une allergie n’était pas retrouvée (16),
mais leurs effets indésirables (et l’évo-
lution chronique récidivante des œsopha-
gites à éosinophiles) incitent à ne pas
les recommander.
L’administration topique de corticoïdes
utilisés dans l’asthme en inhalation, fait
maintenant partie intégrante du traite-
ment. Arora et al. ont obtenu la dispari-
tion prolongée (4 mois) de la dysphagie
chez 21 adultes traités par fluticasone
propionate (FP) 220 µg, 2 fois par jour
en sprays avalés et non inhalés pendant
six semaines, et ont ainsi confirmé les
résultats des essais pédiatriques (5, 16).
Sur le plan histologique, le fluticasone
propionate diminue de façon significa-
tive le nombre des éosinophiles intra-
muqueux et réduit l’inflammation
associée. Les récidives à l’arrêt sont fré-
quentes ; les modalités du traitement à
long terme restent à définir.
L’efficacité du montélukast, (Singu-
lair®) un antagoniste des récepteurs D4
des leukotriènes situés sur la membrane
des éosinophiles, déjà utilisés dans
l’asthme, a été également testée (4). Dans
une étude pilote, (dose initiale : 10 mg/j,
augmentation progressive jusqu’à un
maximum de 100 mg/j pour contrôler
les symptômes, puis décroissance pro-
gressive jusqu’à une dose minimale effi-
cace, située entre 20 et 40 mg/j), le mon-
télukast améliorait la dysphagie de sept
malades sur huit mais celle-ci récidi-
vait quasiment dès l’arrêt du traitement
chez six patients (4).
Les inhibiteurs de la pompe à protons
(IPP) sont recommandés lorsqu’il existe
un RGO associé. Ils doivent être arrêtés
dès lors qu’ils n’entraînent aucune amé-
lioration symptomatique (1, 6).
En cas de sténose, la conduite à tenir
thérapeutique dépend du degré et de la
longueur de la sténose et de la réponse
au traitement médical. En cas de sté-
nose serrée, les dilatations sont néces-
saires dans un tiers des cas.
Les dilatations doivent être prudentes
compte tenu de la fragilité de la muqueuse.
On effectue une dilatation à la bougie
sous scopie, les diamètres maximum
utilisés variaient de 30F à 45F (en
moyenne 39F). On recommande de tou-
jours vérifier l’état de l’œsophage avant
de décider de passer à une bougie de
diamètre supérieur et de ne pas dépasser
6F de progression dans la même séance.
La dilatation se complique fréquemment
d’une déchirure étendue de la paroi œso-
phagienne. Des douleurs thoraciques
postdilatations sont rapportées (1-6),
mais aucun cas de perforation n’a été
décrit dans cette situation. Dans l’étude
de Potter et al., les dilatations étaient
bien tolérées. La durée de leur effet
bénéfique est en moyenne de 8,6 mois
(extrêmes:1à 24mois) (3, 4).
Évolution et pronostic
L’évolution à long terme est encore tota-
lement inconnue. On ne sait pas si les
formes sténosantes constituent une forme
particulière d’œsophagite ou si elles repré-
sentent les conséquences à long terme
d’une infiltration chronique par les éosi-
nophiles non traités. La dysphagie est
chronique bien que variable d’une période
à l’autre. Au bout de 11 ans du suivi de
l’étude de Strauman et al., cette dyspha-
gie chronique persistait dans 96 % des
cas chez 30 patients, elle s’aggravait dans
23 %, était stable dans 37 %, s’amélio-
rait dans 37 %. Seuls 3,4 % n’étaient plus
dysphagiques (un patient) (3). Dans cette
même étude, la quasi-normalité de
l’endoscopie et l’absence d’hyper-éosino-
philie étaient des facteurs d’évolution
plutôt favorables de la dysphagie lors du
suivi (3). La possibilité de dégénéres-
cence ou d’évolution vers un syndrome
hyper-éosinophilique reste hypothétique.
Conclusions
L’incidence des œsophagites à éosino-
philes est en augmentation chez l’adulte :
toute dysphagie à œsophage d’aspect
endoscopique normal doit être biopsiée
(d’autant plus qu’il s’agit d’un sujet
jeune porteur d’un terrain atopique).
Le traitement de cette entité d’évolution
chronique repose essentiellement sur
les corticoïdes locaux. Leur efficacité
et les modalités à long terme restent à
définir. ■
Références
1. Fox VL, Nurko S, Furuta GT. Eosino-
philic esophagitis: it’s not just kid’s stuff.
Gastrointest Endosc 2002;56:260-70.
2. Potter JW, Saein K, Staff D et al. Eosi-
nophilic esophagitis in adults: an emerging
problem with unique esophageal features
Gastroentest Endosc 2004;59:355-61.
3. Straumann S, Sunku B, Nelson SP et al.
Natural history of primary esosinophilic
esophagitis: a follow up of 30 adults patients
for up to 11,5 years. Gastroenterology
2003;125:1660-9.
4. Attwood SEA, Lewis CJ, Bronder CS et al.
Eosinophilic oesophagitis: a novel treatment
using montélukast. Gut 2003; 52:181-5.
5. Arora AS, Perrault J, Smyrk TC. Topical
corticosteroid treatment of dysphagia due
to eosinophilic esophagitis in adults. Mayo
Clin Proc 2003;78:830-5.
6. Croese J, Fairley SK, Masson JW et al.
Clinical and endoscopic features of eosino-
philic esophagitis in adults. Gastrointest
Endosc 2004;58:516-22.
Question d’actualité
Question d’actualité

Question d’actualité
7. Elitsur Y. Eosinophilic esophagitis-is it
in the air. J Pediatr Gastroenterol Nutr
2002;34:325.
8. Straumann A, Rossi L, Simon HU et al.
Fragility of the esophageal mucosa: a
pathognomonic endoscopic sign of primary
eosinophilic esophagitis? Gastrointest
Endosc 2003;57:407-12.
9. Komorowski RA, Hogan WJ. The small
calibre esophagus: an unappreciated cause
of dysphagia for solids in patients with eosi-
nophilic esophagitis. Gastrointest Endosc
2002;55:99-106.
10. Vasilopoulos S, Murphy P, Auerbach
A et al. The small-caliber esophagus: an
unappreciated cause of dysphagia for
solids in patients with eosinophilic oeso-
phagitis. Gastrointest Endosc 2002;55:
99-106.
11. Ahmad M, Soetikno RM, Ahmed A.
The differential diagnosis of eosinophilic
esophagitis. J Clin Gastroenterol 2000;
30:242-4.
12. Mishra A, Hogan SP, Brandt EB,
Rothenberg ME. An etiological role for
aeroallergens and eosinophils in experi-
mental esophagitis. J Clin Invest 2001;
107:83-90.
13. Mishra A, Hogan SP, Brandt EB,
Rothenberg ME. IL-5 promotes eosinophil
trafficking to the esophagus. J Immunol
2002;168:2464-9.
14. Markovitz JE, Spergel JM, Ruchelli PD,
Liacouras CA. Elemental diet is an effec-
tive treatment for eosinophilic esophagitis
in children and adolescents. Am J Gastro-
enterol 2003;98:777-82.
15. Orenstein SR, Shalaby TM, Di
Lorenzo C et al. The spectrum of pediatric
eosinophilic esophagitis beyond infancy:
a clinical series of 30 children. Am J
Gastroenterol 2000;95:1422-30.
16. Teitelbaum JE, Fox VL, Twarog FJ et
al. Eosinophilic esophagitis in children:
immunopathological analysis and res-
ponse to fluticasone. Gastroenterology
2002;122:1216-25.
Sous la présidence du Pr Stanislas Pol (Service d’hépato-gastroentérologie, hôpital Necker-enfants-malades, Paris)
PROGRAMME
(thèmes traités suivant l’actualité du congrès)
» Hépatite B – Dr Tarik Asselah (Service d’hépato-gastroentérologie, hôpital Beaujon, Clichy)
» Hépatite C – Dr Christophe Hezode (Service hépatologie, CHU Henri-Mondor, Créteil)
» Transplantation – Pr Saliba Faouzi (Service hépato-biliaire, hôpitall Paul-Brousse, Villejuif)
» Autres hépatologies chroniques – Pr Philippe Sogni (Service d’hépato-gastroentérologie, hôpital Cochin, Paris)
La réunion de Paris
aura lieu le Jeudi 2 décembre 2004
à 20 h 30 (l’accueil débutera à 20 h 00)
Boston, 30 octobre-2 novembre 2004 2004
AASLD
55th
Salon Orsay-Hilton, 18, avenue de Suffren
75740 PARIS Cedex 15 – Tél. : 01 44 38 56 21
Venez nombreux !
1
/
4
100%