MISE AU POINT
177
La Lettre du Cancérologue - volume XI - n° 5 - septembre-octobre 2002
e principe de la chimiothérapie dans les cancers du
sein repose sur la notion qu’il s’agit d’une maladie
systémique et non purement locorégionale. Il y a
plus d’un siècle, Halsted, considérant le cancer du sein comme
une maladie locorégionale, préconisait des interventions éten-
dues et mutilantes dans un but curatif (1). Cependant, cette
approche locorégionale s’est avérée inadéquate, ne permettant
pas de guérir les patientes présentant une tumeur du sein, même
à un stade précoce. Le principe de dissémination précoce a été
mis en évidence par Fisher, stipulant que cette dissémination
pouvait s’effectuer en dehors de la voie lymphatique, par voie
sanguine (2). Des micrométastases à distance peuvent s’observer
dans 30 à 90 % des tumeurs du sein. En effet, ces dernières
années, l’existence d’une maladie micrométastatique médul-
laire à des stades précoces (T1) a été caractérisée et corrélée de
façon indépendante avec la survie sans métastase (3). L’admi-
nistration d’une chimiothérapie précoce pouvait donc avoir
une action sur la maladie micrométastatique. Fondée sur ces
considérations théoriques, l’administration d’un traitement
systémique (chimiothérapie ou hormonothérapie), a été initia-
lement introduite chez les patientes présentant une tumeur du
sein à haut risque (N+) et puis chez les patientes N0. Le béné-
fice à long terme de cette approche a été clairement établi (4).
Simultanément au développement de la chimiothérapie
adjuvante, la chimiothérapie néoadjuvante, ou première, ou
préopératoire a été introduite dans les cancers du sein locale-
ment avancés (5, 6). Cette approche a permis d’améliorer
le contrôle locorégional et la survie. Chez des patientes sélec-
tionnées, un traitement conservateur était réalisable. La chimio-
thérapie néoadjuvante est donc devenue un standard dans les
cancers du sein localement avancés. Puis ce concept a été
introduit dans la prise en charge des cancers du sein à un stade
plus précoce (7). En effet, dans des études précliniques, Fisher
avait démontré que l’ablation de la tumeur primitive augmen-
tait la croissance des cellules métastatiques résiduelles (8, 9).
Cet effet est attribué à un facteur de croissance sérique et il est
annulé par un traitement préopératoire par cyclophosphamide
ou tamoxifène. L’introduction d’un traitement systémique plus
rapidement après le diagnostic entraîne une amélioration des
résultats par rapport à un traitement différé (2).
On définit donc par chimiothérapie première ou néoadjuvante
la chimiothérapie administrée avant tout traitement locorégional.
Cette démarche est obligatoire dans les cancers du sein inflam-
matoires et localement avancés ; elle est par contre optionnelle
dans les cancers du sein dits “opérables”. Cette revue se focalise
sur la chimiothérapie néoadjuvante optionnelle des cancers du
sein opérables.
Les avantages théoriques de la chimiothérapie néoadjuvante
reposent sur différentes hypothèses :
– Elle permettrait une action plus rapide sur la croissance des
micrométastases, ce qui devrait entraîner une augmentation de
la survie des patientes.
– La réduction du volume tumoral, ou downstaging, induite par
la chimiothérapie donnerait la possibilité d’augmenter le taux
de conservation mammaire.
-– Ce traitement préopératoire donne l’opportunité d’évaluer la
réponse tumorale in vivo. En cas d’absence de réponse au trai-
tement systémique, le régime inefficace peut être interrompu
pour éviter une toxicité inutile et instituer un traitement alter-
natif plus efficace.
– Ainsi la réponse de la tumeur primitive représente-t-elle un
marqueur de remplacement ou surrogate marker du comporte-
ment des cellules micrométastatiques disséminées à distance.
Cette hypothèse est fondée sur la relation étroite entre réponse
histologique à la chimiothérapie et survie à long terme.
Plusieurs limites potentielles ont été évoquées (10). Il s’agit :
– du surtraitement possible de certaines tumeurs ;
– du risque de progression tumorale sous chimiothérapie ;
– de la perte des facteurs pronostiques préopératoires, essen-
tiellement les données du curage axillaire. Cependant, les don-
nées du curage axillaire restent toujours un facteur pronostique
majeur après chimiothérapie néoadjuvante (11).
Le surtraitement de la maladie est représenté essentiellement
dans les cas où la biopsie du cancer du sein ne semblerait pas
suffisante pour affirmer le caractère invasif de la tumeur. Dans
les grandes séries de la littérature, ce taux paraît très faible :
4% dans l’étude du Royal Marsden (12) et 1,6 % dans l’étude
du NSABP B18 (13). L’utilisation de biopsies de type tru-cut
permet d’éviter, dans la très grande majorité des cas, le risque
de traiter un cancer du sein qui ne serait pas infiltrant. D’autre
part, les indications de la chimiothérapie adjuvante se sont lar-
gement étendues ces dernières années (14, 15). Selon ces
consensus, seules les tumeurs du sein de taille inférieure à 1 ou
2 cm de grade SBR1, et avec des récepteurs hormonaux posi-
tifs, ne devraient pas recevoir de chimiothérapie adjuvante. La
Chimiothérapie néoadjuvante dans les cancers du sein
●V. Diéras*, V. Laurence*, J.Y. Pierga*
* Institut Curie, Paris
.
L

MISE AU POINT
178
La Lettre du Cancérologue - volume XI - n° 5 - septembre-octobre 2002
réalisation de biopsies de tumeurs dont la taille est supérieure à
2 cm, permettant la détermination des caractéristiques histolo-
giques, du grade, des récepteurs hormonaux, doit limiter un
surtraitement des patientes.
LA RÉPONSE OBJECTIVE À LA CHIMIOTHÉRAPIE
Plusieurs études de phase II ont démontré la faisabilité de cette
approche chez les patientes présentant une tumeur du sein à un
stade précoce (16-19). Ces études ont confirmé un taux de
réponse objective élevé et une augmentation du taux de traite-
ment conservateur par comparaison aux contrôles historiques
(tableau I). Fondées sur ces considérations, différentes études
de phase III ont été réalisées dont l’objectif principal était de
démontrer une amélioration de la survie sans récidive et glo-
bale. Le second objectif était d’augmenter le taux de traitement
conservateur. Les premières études randomisées, réalisées
avec différents protocoles de chimiothérapie, ont donc permis
de comparer la démarche néoadjuvante à la démarche adju-
vante (tableau II). Dans ces études, les taux de survie sans
récidive à 5 ans et de survie à 10 ans ne montrent pas de diffé-
rence significative entre ces deux approches mais une diffé-
rence en taux de traitement conservateur.
Plus récemment, deux grande études, américaine (NSABP
B18) (13, 20) et européenne (EORTC 10902) (21), ont validé
cette approche en confirmant l’absence de différence en survie à
5 ans (tableau III). Cependant, dans l’approche néoadjuvante,
différents éléments semblaient avoir un impact sur la survie
sans récidive et la survie globale, la réponse complète histolo-
gique représentant le facteur plus important pour la survie (22).
ÉVALUATION DE LA RÉPONSE
Un des problèmes de la chimiothérapie néoadjuvante est l’éva-
luation de la réponse.
La réponse clinique est jugée selon les critères de l’OMS. Les
examens d’imagerie classique sont représentés par l’échographie
et la mammographie. Cependant, certains auteurs ont noté
l’absence de corrélation nette entre ces différents examens et la
réponse histologique (Golsdirsh annals oncol). Plus récemment,
l’apport de l’IRM est à l’étude (23) de même que l’échographie
pulsée et le PET-scan (24, 25).
La réponse histologique doit être appréciée au niveau de la
tumeur et des ganglions. Il existe différentes classifications rendant
parfois difficile la comparaison entre les études (tableau IV).
AUGMENTATION DU TAUX DE CONSERVATION MAMMAIRE
ET RISQUE DE RECHUTE LOCALE
Initialement, la chimiothérapie néoadjuvante a été développée
essentiellement dans ce but et les premières études randomisées
ont confirmé l’augmentation du taux de traitement conservateur
par la chimiothérapie néoadjuvante. Cependant, une des ques-
tions posées est le risque de rechute locale après traitement
conservateur postchimiothérapie. Dans l’essai B18 du NSABP,
le taux de traitement conservateur est de 68 % dans le bras
néoadjuvant versus 60 % dans le bras adjuvant (22). L’inci-
dence cumulée de rechute locale est de 9,9 % dans le bras
néoadjuvant versus 7,1 % dans le bras adjuvant, différence non
statistiquement significative (p = 0,11). Cependant, il faut sou-
ligner que dans cet essai il existait une forte proportion de
Tableau I. D’après (41).
Essai N Stade Protocole % % réponses %
réponses histologiques réponses
complètes complètes
Jacquillat 250 I-IIIB VTMF 30 ND 71
(16) +/-A
Bonadonna 161 3 cm CMF, CAF, 17 4 77
(42) FEC
Tubiana-Hulin 150 IIIA AVCMF 47
(43)
Belembaogo 126 Opérable AVCF 36 7 85
(17) AVCMF
Smith 84 Opérable CMF, MMM, 17 69
(44) FEC
Chollet 50 Opérable TCNF 51 30 88
(45) haut risque
Gradishar 33 Stade III T puis AC 18 3 85
(35)
Tableau II.
Étude N % survie % survie
à 5 ans à 10 ans
Ragaz 204
•
Mastectomie puis CMF 73
•
1 CMF puis chirurgie - 74
8 cycles
Semiglazov 271
•
TMF + RT 81 78
(46) puis mastectomie - CT
•
RT puis chirurgie puis TMF x 6 72 86
Mauriac (26) 272
•
Mastectomie puis EMV- 88 NS
MTV + Tam
•
3EVM-3MTV puis chirurgie 84
Powles (12) 212
•
M3 - Chir - 3M + Tam 78
•
Chir - 3M + Tam 78 NA
(à 4 ans)
Scholl (47) 414
•
FAC - RT - Chir 65
•
Rt - Chir - FAC 60
Tableau III.
Étude N % survie % survie
à 5 ans à 10 ans
NSABP B18 1 523
•
Chirurgie puis 4 AC 80 NA
(20)
•
4 AC puis chirurgie 80
EORTC 10902 698
•
Chirurgie puis 4 FEC 85 NA
Van der Hage
•
4 FEC puis chirurgie 81
(21)
Tableau IV. Différentes classifications des réponses histologiques.
Auteur Année
Chevallier (49) 1993 pCR : réponse ganglionnaire incluse
Miller et Payne (37) 1994
Sataloff (50) 1995
Honkoop (51) 1998 pCR : réponse ganglionnaire incluse
Fisher (20) 1998
Kuerer (52) 1999

179
La Lettre du Cancérologue - volume XI - n° 5 - septembre-octobre 2002
tumeur T1 (29 %) (13). Dans l’essai de Bordeaux, les patientes
étaient randomisées entre mastectomie première suivie de
chimiothérapie adjuvante, sans radiothérapie (groupe A :
138 patientes) versus chimiothérapie adjuvante puis radio-
thérapie en cas de réponse complète, tumorectomie associée à
la radiothérapie en cas de réponse partielle avec tumeur rési-
duelle ≤2 cm, mastectomie en cas de tumeur résiduelle > 2 cm.
Le taux de conservation mammaire à 10 ans était de 91 % versus
74 % respectivement pour la mastectomie première et la chimio-
thérapie néoadjuvante (26).
OPPORTUNITÉ D’ÉVALUER LA RÉPONSE TUMORALE IN VIVO
Dans une série rétrospective de l’Institut Curie, la survie glo-
bale paraît corrélée à la réponse clinique (p < 0,0001) (27).
Cependant, la réponse clinique est parfois d’appréciation difficile.
Dans l’essai B18 du NSABP, 36 % (n = 249) des patientes ont
présenté une réponse complète clinique. Parmi elles, on notait
9% de réponse histologique complète, 4 % de réponse majeure
(carcinome in situ) et, dans 23 % des cas, la persistance d’un
contingent infiltrant. Le taux de réponse complète histologique
(réponse complète + persistance in situ) est de 13 %. Le critère
de la réponse histologique complète paraît être le meilleur
facteur pronostique en termes de maladie sans récidive
(p = 0,00005) et de survie globale (p = 0,0008) (20, 22). La
réponse histologique est également retrouvée comme facteur
pronostique majeur dans une série française publiée récem-
ment (28). La réponse peut être appréciée également au niveau
de la maladie micrométastatique (29). La persistance de cel-
lules micrométastatiques médullaires après chimiothérapie
néoadjuvante apparaît comme un facteur de mauvais pronostique,
ce qui conforte dans l’idée que ces cellules micrométastatiques
sont quiescentes et donc peu sensibles à la chimiothérapie.
PERSPECTIVES
Augmentation du taux de réponse complète histologique
avec comme corollaire l’augmentation de la survie
La réponse complète histologique apparaissant comme le
meilleur facteur pronostique à l’égard de la survie, les
approches thérapeutiques des dernières années se sont focalisées
sur l’augmentation de la réponse et donc l’introduction de nou-
veaux agents. Les taxanes représentant une classe d’agents
actifs dans le cancer du sein métastatique, leur utilisation en
néoadjuvant a été évaluée dans de nombreux essais de phase II
(30-34). Cependant, l’inclusion des taxanes, soit en mono-
thérapie, soit en association avec les anthracyclines, n’a pas
conduit à une augmentation significative des taux de réponse
histologique, de 5 à 13 % (35, 36). En fait, les approches
séquentielles semblent plus intéressantes, permettant d’admi-
nistrer des agents à leur dose optimale et d’évaluer plus préci-
sément l’apport de ces nouveaux agents dans la stratégie théra-
peutique néoadjuvante.
Dans cette optique, le but de l’essai du groupe d’Aberdeen
était de déterminer si l’introduction du Taxotère®dans un pro-
tocole de chimiothérapie néoadjuvante entraînerait un bénéfice
en survie chez les patientes présentant une tumeur du sein non
accessible à un traitement conservateur ou localement avancée
(37). Les patientes présentant une tumeur du sein (T2 > 4 cm,
T3 ou T4) ont reçu 4 cycles de CVAP (cyclophosphamide,
vincristine, doxorubicine, prednisone). Après évaluation de la
réponse clinique, les patientes présentant une réponse partielle
ou une réponse complète étaient randomisées entre 4 cycles
supplémentaires de CVAP ou 4 cycles de Taxotère®. Les
patientes ne présentant pas de réponse recevaient 4 cycles de
Taxotère®. Cent soixante-sept patientes ont été incluses dans
l’étude, 162 patientes étaient éligibles, 104 patientes ont
présenté une réponse et ont été randomisées. Le suivi médian
est de 38 mois (24-52). Les taux de réponses clinique et
pathologique ont été significativement supérieurs dans le bras
Taxotère®: 94 % de réponse clinique avec le Taxotère®contre
66 % avec le CVAP. Le taux de réponse histologique complète
est passé de 18 % après 8 cures de CVAP à 34 % avec 4 CVAP
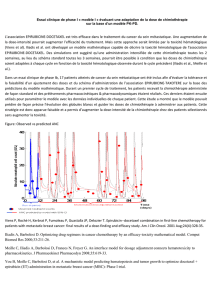
puis 4 Taxotère®. De même, l’avantage en survie se manifeste
dans le bras Taxotère®(figure 1). Une chimiothérapie adjuvante
avec Taxotère®suivant un traitement par anthracyclines
entraîne une meilleure survie sans récidive et survie globale par
comparaison au groupe recevant le protocole avec anthracy-
clines. De même, le NSABP dans le protocole B27 a testé
l’apport de 4 cycles de Taxotère®dans la stratégie néoadju-
vante par rapport au bras contrôle du NSABP B18 (38). Dans
cet essai, 2 411 patientes ont été randomisées entre trois bras
de traitement : (I) 4 AC (adriamycine 60 mg/m2, cyclophos-
phamide 600 mg/m2) puis chirurgie ; (II) 4 AC plus 4 cycles de
Taxotère®(100 mg/m2) puis chirurgie ; (III) 4 AC, chirurgie
puis 4 cycles de Taxotère®. L’addition de Taxotère®augmente
de façon significative le taux de réponse objective de 60 %, de
réponse complète pathologique de 87 % et le downstaging
ganglionnaire est de 15 %. L’analyse finale permettra de
conclure si ce bénéfice en réponse se traduit par un bénéfice en
survie et de déterminer quel sous-groupe de patientes bénéfi-
cierait le plus de l’apport du Taxotère®. De même, compte tenu
des résultats observés en phase métastatique, certains essais
évaluent l’apport du trastuzumab en situation néoadjuvante
chez les patientes présentant une surexpression de c-erbB-2
(39).
Figure 1. Survie sans progression
(cité par [48]).
1,0
Réponse initiale de CVAP
randomisation du docétaxel
Réponse initiale de CVAP
randomisation du docétaxel
p = 0,022
Pas de réponse de CVAP
crossover du docétaxel
Durée (semaines)
Probabilité
0,9
0,8
0,7
0,6

180
La Lettre du Cancérologue - volume XI - n° 5 - septembre-octobre 2002
MISE AU POINT
PRÉDICTION DE LA RÉPONSE ET PERSONNALISATION
DU TRAITEMENT
Les facteurs pronostiques et prédictifs lors des traitements
néoadjuvants sont mieux précisés et devraient permettre
d’adapter le traitement aux caractéristiques tumorales des
patientes. Un élément pronostique majeur est représenté par le
degré d’envahissement ganglionnaire après traitement
néoadjuvant (11). Dans cette étude, la survie globale est reliée
de façon significative au nombre de ganglions positifs
(p < 0,0001). Dans l’étude d’Aberdeen, le principal facteur
prédictif de la réponse histologique est l’absence de récepteurs
aux estrogènes (p = 0,01) (37). De même, dans une étude
rétrospective de l’Institut Curie, les facteurs prédictifs de la
réponse clinique sont la taille tumorale, le grade histologique
et l’absence de récepteurs hormonaux (27).
Dans un futur proche, la prédiction de la réponse se fera sur
des marqueurs individuels, pathologiques et biochimiques,
permettant la définition d’index prédictifs. L’imagerie fonc-
tionnelle pourrait jouer un rôle dans l’évaluation précoce de la
réponse, permettant d’adapter le traitement avant la chirurgie.
Enfin, la caractérisation du profil génétique des tumeurs per-
mettrait, dans l’idéal, un traitement personnalisé (40).
De nombreuses questions restent posées en situation néoadju-
vante :
– traitement concomitant versus séquentiel ;
– apport des taxanes ;
– durée optimale de traitement ;
– rôle d’un traitement postopératoire “adjuvant postadjuvant”
en fonction des résultats histologiques ;
– nouvelles associations, notamment les sels de platine et
le trastuzumab, chez les patientes dont la tumeur surexprime
c-erbB-2 ;
– rôle potentiel d’une intensification dans les tumeurs très pro-
lifératives ;
– association à une hormonothérapie dans les tumeurs RH+
(séquentielle ou concomitante) ;
– place du ganglion sentinelle (avant ou après chimiothérapie
néoadjuvante).
CONCLUSION
La chimiothérapie néoadjuvante présente potentiellement un
meilleur index thérapeutique que la chimiothérapie adjuvante.
Elle entraîne un contrôle locorégional, une survie sans récidive
et une survie à long terme similaires à la chimiothérapie adju-
vante. De plus, l’approche néoadjuvante fournit plusieurs
avantages thérapeutiques majeurs. Un des principaux est la
possibilité d’évaluer la réponse in vivo. De plus, la réduction
tumorale améliore la possibilité de traitement conservateur.
Actuellement, plusieurs questions restent en suspens. Nous
avons besoin de développer de meilleurs marqueurs biolo-
giques pour être plus sélectifs dans nos approches. Le rôle de
l’hormonothérapie préopératoire n’a pas encore été défini mais
devrait être établi dans des essais cliniques : avant, pendant la
chimiothérapie ou après. Après chimiothérapie néoadjuvante,
la séquence thérapeutique optimale n’est pas clairement définie
(association de différentes modalités, addition de cycles de
chimiothérapie supplémentaires ou différents). Le suivi à plus
long terme des essais, comme le NSABP B27, devrait permettre
de répondre en partie à cette question. Le rôle du ganglion sen-
tinelle est en cours d’évaluation dans cette approche. De plus,
l’amélioration des connaissances en biologie moléculaire
conduit à l’identification de nouvelles cibles thérapeutiques.
Des anticorps monoclonaux dirigés contre des antigènes spéci-
fiques, des oncogènes, des facteurs de croissance ou leurs
récepteurs, des agents affectant la transmission des signaux
(par exemple les inhibiteurs de la tyrosine-kinase et de farnésyl
transférase) ou l’angiogenèse tumorale et l’apoptose ouvrent la
possibilité de stratégies thérapeutiques innovantes et potentiel-
lement plus sélectives dans le traitement initial des cancers du
sein. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Halsted WS. The results of radical operation for the cure of carcinoma of the
breast. Ann Surg 1907 ; 46 : 1-19.
2. Fisher B, Saffer E, Gunduz N, Coyle J, Rudock C. Serum growth factor follo-
wing primary tumor removal and the inhibition of its production by preoperati-
ve therapy. Prog Clin Biol Res 1990 ; 354A : 47-60.
3. Braun S, Pantel K, Muller P, Janni W, Hepp F, Kentenich CR et al.
Cytokeratin-positive cells in the bone marrow and survival of patients with stage
I, II, or III breast cancer. N Engl J Med 2000 ; 342 (8) : 525-33.
4. Early Breast Cancer Trialists’ Collaborative Group. Polychemotherapy for
early breast cancer : an overview of the randomized trials. Lancet 1998 ; 352
(9132) : 930-42.
5. Rubens RD. The management of locally advanced breast cancer. Br J Cancer
1992 ; 65 (2) : 145-7.
6. Singletary SE, McNeese MD, Hortobagyi GN. Feasibility of breast-conserva-
tion surgery after induction chemotherapy for locally advanced breast carcino-
ma. Cancer 1992 ; 69 (11) : 2849-52.
7. Bonadonna G, Valagussa P, Zucali R, Salvadori B. Primary chemotherapy in
surgically resectable breast cancer. CA Cancer J Clin 1995 ; 45 (4) : 227-43.
8. Fisher B, Gunduz N, Saffer EA. Influence of the interval between primary
tumor removal and chemotherapy on kinetics and growth of metastases. Cancer
Res 1983 ; 43 (4) : 1488-92.
9. Fisher B, Gunduz N, Coyle J, Rudock C, Saffer E. Presence of a growth-sti-
mulating factor in serum following primary tumor removal in mice. Cancer Res
1989 ; 49 (8) : 1996-2001.
10. Brenin DR, Morrow M. Breast-conserving surgery in the neoadjuvant set-
ting. Semin Oncol 1998 ; 25 (2 Suppl. 3) : 13-8.
11. Pierga JY, Mouret E, Diéras V, Laurence V, Beuzeboc P, Dorval T et al.
Prognostic value of persistent node involvement after neoadjuvant chemotherapy
in patients with operable breast cancer. Br J Cancer 2000 ; 83 (11) : 1480-7.
12. Powles TJ, Hickish TF, Makris A, Ashley SE, O’Brien ME, Tidy VA et al.
Randomized trial of chemoendocrine therapy started before or after surgery for
treatment of primary breast cancer. J Clin Oncol 1995 ; 13 (3) : 547-52.
13. Fisher B, Brown A, Mamounas E, Wieand S, Robidoux A, Margolese RG et
al. Effect of preoperative chemotherapy on local-regional disease in women with
operable breast cancer : findings from National Surgical Adjuvant Breast and
Bowel Project B18. J Clin Oncol 1997 ; 15 (7) : 2483-93.
14. Goldhirsch A, Glick JH, Gelber RD, Coates AS, Senn HJ. Meeting highlights :
International Consensus Panel on the Treatment of Primary Breast Cancer.
Seventh International Conference on Adjuvant Therapy of Primary Breast
Cancer. J Clin Oncol 2001 ; 19 (18) : 3817-27.

15. National Institutes of Health Consensus Development Panel. National Institutes
of Health Consensus Development Conference Statement : Adjuvant Therapy for
Breast Cancer, November 1-3, 2000. J Natl Cancer Inst 2001 ; 93 : 979-89.
16. Jacquillat C, Weil M, Baillet F, Borel C, Auclerc G, de Maublanc MA et al.
Results of neoadjuvant chemotherapy and radiation therapy in the breast-conser-
ving treatment of 250 patients with all stages of infiltrative breast cancer. Cancer
1990 ; 66 (1) : 119-29.
17. Belembaogo E, Feillel V, Chollet P, Cure H, Verrelle P, Kwiatkowski F et al.
Neoadjuvant chemotherapy in 126 operable breast cancers. Eur J Cancer 1992 ;
28A (4-5) : 896-900.
18. Calais G, Berger C, Descamps P, Chapet S, Reynaud-Bougnoux A, Body G
et al. Conservative treatment feasibility with induction chemotherapy, surgery
and radiotherapy for patients with breast carcinoma larger than 3 cm. Cancer
1994 ; 74 (4) : 1283-8.
19. Brain E, Garrino C, Misset JL, Carbonero IG, Itzhaki M, Cvitkovic E et al.
Long-term prognostic and predictive factors in 107 stage II/III breast cancer
patients treated with anthracycline-based neoadjuvant chemotherapy. Br J Cancer
1997 ; 75 (9) : 1360-7.
20. Fisher B, Bryant J, Wolmark N, Mamounas E, Brown A, Fisher ER et al.
Effect of preoperative chemotherapy on the outcome of women with operable
breast cancer. J Clin Oncol 1998 ; 16 (8) : 2672-85.
21. Van der Hage JA, van de Velde CJ, Julien JP, Tubiana-Hulin M,
Vandervelden C, Duchateau L. Preoperative chemotherapy in primary operable
breast cancer : results from the European Organization for Research and
Treatment of Cancer Trial 10902. J Clin Oncol 2001 ; 19 (22) : 4224-37.
22. Wolmark N, Wang J, Mamounas E, Bryant J, Fisher B. Preoperative che-
motherapy in patients with operable breast cancer : nine-year results from natio-
nal surgical adjuvant breast and bowel project B-18. J Natl Cancer Inst Monogr
2001 ; 30 : 96-102.
23. Rieber A, Brambs HJ, Gabelmann A, Heilmann V, Kreienberg R, Kuhn T.
Breast MRI for monitoring response of primary breast cancer to neoadjuvant
chemotherapy. Eur Radiol 2002 ; 12 (7) : 1711-9.
24. Mankoff DA, Dunnwald LK, Gralow JR, Ellis GK, Charlop A, Lawton TJ et
al. Blood flow and metabolism in locally advanced breast cancer : relationship
to response to therapy. J Nucl Med 2002 ; 43 (4) : 500-9.
25. Schelling M, Avril N, Nahrig J, Kuhn W, Romer W, Sattler D et al. Positron
emission tomography using [(18)F]Fluorodeoxyglucose for monitoring primary
chemotherapy in breast cancer. J Clin Oncol 2000 ; 18 (8) : 1689-95.
26. Mauriac L, MacGrogan G, Avril A, Durand M, Floquet A, Debled M et al.
Neoadjuvant chemotherapy for operable breast carcinoma larger than 3 cm : a
unicentre randomized trial with a 124-month median follow-up. Institut Bergonié
Bordeaux Groupe Sein (IBBGS). Ann Oncol 1999 ; 10 (1) : 47-52.
27. Pierga JY, Mouret E. 2002.
28. Chollet P, Amat S, Cure H, de Latour M, Le Bouedec G, Mouret-Reynier MA
et al. Prognostic significance of a complete pathological response after induction
chemotherapy in operable breast cancer. Br J Cancer 2002 ; 86 (7) : 1041-6.
29. Braun S, Kentenich C, Janni W, Hepp F, de Waal J, Willgeroth F et al. Lack
of effect of adjuvant chemotherapy on the elimination of single dormant tumor
cells in bone marrow of high-risk breast cancer patients. J Clin Oncol 2000 ; 18
(1) : 80-6.
30. Von Minckwitz G, Costa SD, Eiermann W et al. Maximized reduction of pri-
mary breast tumor size using preoperative chemotherapy with doxorubicin and
docetaxel. J Clin Oncol 1999 ; 17 (7) : 1999-2005.
31. Von Minckwitz G, Costa SD, Raab G, Blohmer JU, Eidtmann H, Hilfrich J
et al. Dose-dense doxorubicin, docetaxel and granulocyte colony-stimulating
factor support with or without tamoxifen as preoperative therapy in patients with
operable carcinoma of the breast : a randomized, controlled, open phase IIb
study. J Clin Oncol 2001 ; 19 (15) : 3506-15.
32. Buzdar AU, Singletary SE, Theriault RL, Booser DJ, Valero V, Ibrahim N et
al. Prospective evaluation of paclitaxel versus combination chemotherapy with
fluorouracil, doxorubicin and cyclophosphamide as neoadjuvant therapy in
patients with operable breast cancer. J Clin Oncol 1999 ; 17 (11) : 3412-7.
33. De Matteis A, Nuzzo F, D’Aiuto G, Labonia V, Landi G, Rossi E et al.
Docetaxel plus epidoxorubicin as neoadjuvant treatment in patients with large
operable or locally advanced carcinoma of the breast : a single-center, phase II
study. Cancer 2002 ; 94 (4) : 895-901.
34. Miller KD, McCaskill-Stevens W, Sisk J, Loesch DM, Monaco F, Seshadri R
et al. Combination versus sequential doxorubicin and docetaxel as primary
chemotherapy for breast cancer: a randomized pilot trial of the hoosier oncology
group. J Clin Oncol 1999 ; 17 (10) : 3033-7.
35. Gradishar WJ. Primary (neoadjuvant) chemotherapy with docetaxel in
breast cancer. Clin Breast Cancer 2001 ; 2 (Suppl. 1) : S31-5.
36. Costa SD, von Minckwitz G, Raab G, Blohmer JU, Dresel V, Eidtmann H et al.
The role of docetaxel (Taxotere®) in neoadjuvant chemotherapy of breast cancer.
Semin Oncol 1999 ; 26 (3 Suppl 9) : 24-31.
37. Miller ID, Payne S, Smith IC, Heys SD, Hutcheon AW, Gilbert FJ et al.
Neoadjuvant chemotherapy in breast cancer : significantly enhanced response
with docetaxel. J Clin Oncol 2002 ; 20 (6) : 1456-66.
38. NSABP. The effect on primary tumor response of adding sequential Taxotere®
to adriamycin and cyclophosphamide : preliminary results from NSABP Protocol
B27. Breast Cancer Res Treat 2001 : (abstract).
39. Hurley J, Doliny P, Silva O, Gomez-Fernandez C, Resi I, Velez P et al.
Neoadjuvant Herceptin®/Taxotere®/cisplatin in the treatment of locally advanced
and inflammatory breast cancer. Proc Am Soc Clin Oncol 2002 ; 21 : (abstract) : 196.
40. Van ‘t Veer LJ, Dai H, van de Vijver MJ, He YD, Hart AA, Mao M, et al.
Gene expression profiling predicts clinical outcome of breast cancer. Nature
2002 ; 415 (6871) : 530-6.
41. Mamounas EP, Fisher B. Preoperative (neoadjuvant) chemotherapy in
patients with breast cancer. Semin Oncol 2001 ; 28 (4) : 389-99.
42. Bonadonna G, Veronesi U, Brambilla C, Ferrari L, Luini A, Greco M et al.
Primary chemotherapy to avoid mastectomy in tumors with diameters of three
centimeters or more. J Natl Cancer Inst 1990 ; 82 (19) : 1539-45.
43. Tubiana-Hulin M, Malek M, Briffod M et al. Preoperative chemotherapy of
operable breast cancer (stage IIIA). Prognostic factor of distant recurrence. Eur
J Cancer 1993 ; 29A (S76) (Suppl. 6) : abstract 391.
44. Smith IE, Jones AL, O’Brien ME, McKinna JA, Sacks N, Baum M. Primary
medical (neoadjuvant) chemotherapy for operable breast cancer. Eur J Cancer
1993 ; 29A (12) : 1796-9.
45. Chollet P, Charrier S, Brain E, Cure H, van Praagh I, Feillel V et al. Clinical
and pathological response to primary chemotherapy in operable breast cancer.
Eur J Cancer 1997 ; 33 (6) : 862-6.
46. Semiglazov VF, Topuzov EE, Bavli JL, Moiseyenko VM, Ivanova OA, Seleznev
IK et al. Primary (neoadjuvant) chemotherapy and radiotherapy compared with
primary radiotherapy alone in stage IIb-IIIa breast cancer. Ann Oncol 1994 ;
5 (7) : 591-5.
47. Scholl SM, Fourquet A, Asselain B, Pierga JY, Vilcoq JR, Durand JC et al.
Neoadjuvant versus adjuvant chemotherapy in premenopausal patients with
tumours considered too large for breast conserving surgery : preliminary results
of a randomized trial S6. Eur J Cancer 1994 ; 30A : 645-52.
48. Aapro MS. Neoadjuvant therapy in breast cancer : can we define its role ?
Oncologist 2001 ; 6 (Suppl 3) : 36-9.
49. Chevallier B, Roche H, Olivier JP, Chollet P, Hurteloup P. Inflammatory
breast cancer. Pilot study of intensive induction chemotherapy (FEC-HD) results
in a high histologic response rate. Am J Clin Oncol 1993 ; 16 (3) : 223-8.
50. Sataloff DM, Mason BA, Prestipino AJ, Seinige UL, Lieber CP, Baloch Z.
Pathologic response to induction chemotherapy in locally advanced carcinoma of
the breast : a determinant of outcome. J Am Coll Surg 1995 ; 180 (3) : 297-306.
51. Honkoop AH, van Diest PJ, de Jong JS, Linn SC, Giaccone G, Hoekman K
et al. Prognostic role of clinical, pathological and biological characteristics in
patients with locally advanced breast cancer. Br J Cancer 1998 ; 77 (4) : 621-6.
52. Kuerer HM, Newman LA, Smith TL, Ames FC, Hunt KK, Dhingra K et al.
Clinical course of breast cancer patients with complete pathologic primary
tumor and axillary lymph node response to doxorubicin-based neoadjuvant che-
motherapy. J Clin Oncol 1999 ; 17 (2) : 460-9.
Tous les articles publiés dans La Lettre du Cancérologue le sont sous la seule responsabilité de leurs auteurs.
Edimark S.A., 62-64, rue Jean-Jaurès, 92800 Puteaux
Tous droits réservés - Dépôt légal : à parution - © mai 1992 - Edimark S.A. - Imprimé en France - Point 44 - 94500 Champigny-sur-Marne
Avec ce numéro sont routés : un encart Glivec (sous la couverture), un Infos Congrès 7eCongrès de l’European Hematology Association, réalisé en collaboration
avec les laboratoires Schering AG, un encart de 4 pages du GERCOR, un supplément “Actualités sur l’oxaliplatine à l’ASCO 2002”, en partenariat avec Sanofi synthéase
(réservé aux abonnés), un flyer e-journal San Antonio est routé avec ce numéro ainsi qu’un bulletin d’abonnement réservé aux prospects.
1
/
5
100%