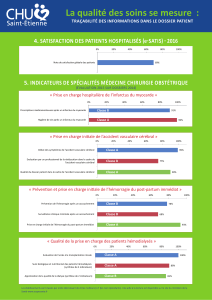
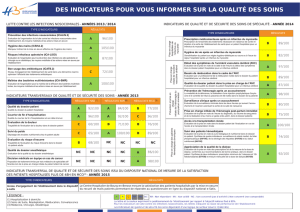
Lire l'article complet

Cet état de fait est double-
ment regrettable :
✓Le traitement des sté-
noses carotides sympto-
matiques est aujourd’hui
bien codifié, grâce aux
résultats largement
concordants des essais
NASCET et ECST. Il n’en
est pas de même pour les
sténoses asympto-
matiques, pour lesquelles nous ne dispo-
sons que du seul essai ACAS, dont les
résultats ne font pas l’objet d’un consen-
sus (2). Le neurologue, étant le plus apte
à poser le diagnostic d’accident isché-
mique cérébral (3), a donc un rôle pri-
mordial dans l’appréciation de l’indica-
tion opératoire (4) et dans l’évaluation
des complications neurologiques de la
procédure, les chirurgiens ayant tendance
à sous-estimer d’un facteur 2 à 3 les
évé-
nements neurologiques postopératoires (5).
✓N’ayant pas de conflit d’intérêts avec
le patient, il est le plus à même de lui
apporter une information précise et indé-
pendante sur le risque spontané d’infarc-
tus cérébral, l’objectif de l’endartériecto-
mie et ses complications éventuelles (4).
Il s’agit bien d’un rôle de conseiller
concernant un acte de prévention avec un
risque immédiat pour un bénéfice à long
terme, la décision finale appartenant au
patient. Cette revue aborde les questions
les plus courantes rencontrées en pra-
tique quotidienne.
Qu’est-ce qu’une sténose
carotidienne symptomatique ?
Une sténose carotidienne symptoma-
tique est définie par l’existence d’un
accident ischémique transitoire (AIT) ou
constitué dans le territoire d’aval. Il
s’agit d’une définition clinique, dont
sont exclus les accidents ischémiques du
territoire carotidien controlatéral ou ver-
tébro-basilaire et les démences. La diffi-
culté à attribuer certains symptômes
(dysarthrie, trouble visuel…) à un terri-
toire précis peut nécessiter une IRM de
diffusion pour localiser le siège des
lésions.
Par ailleurs, la coexisten-
ce fréquente de causes
multiples oblige à effec-
tuer un bilan complet
devant un accident
ischémique : une fibrilla-
tion auriculaire,
une car-
diopathie ischémique, une
sténose
intracrânienne
peuvent coexister avec
une sténose carotidienne.
La présence de causes annexes d’infarc-
tus cérébral chez un patient conduisait à
l’exclure des essais thérapeutiques. En
pratique clinique, dans une telle situa-
tion, il est préférable d’évaluer le risque
propre conféré par chaque cause poten-
tielle d’infarctus cérébral afin d’attribuer
l’accident à celle conférant le risque le
plus élevé, ce qui permet d’adapter le
traitement en conséquence.
Quand et comment faut-il
détecter une sténose caroti-
dienne symptomatique ?
Compte tenu des incertitudes sur le
bénéfice de la chirurgie des sténoses
asymptomatiques, il n’y a pas de justi-
fication à les dépister en l’absence
d’accident ischémique carotidien. En
particulier, en l’absence de bénéfice
démontré de la chirurgie carotidienne
dans la prévention des infarctus céré-
Act. Méd. Int. - Neurologie (4) n° 1, janvier 2002 135
plate-forme
*Philippe Niclot est neurologue, attaché à
temps plein dans le service de neurologie
du Pr Amarenco à l’hôpital Bichat où il a
particulièrement travaillé sur la place des
anticoagulants à la phase aiguë des acci-
dents vasculaires cérébraux.
Les sténoses carotidiennes expliquant moins de 10 %
des infarctus cérébraux (1), les neurologues sont rare-
ment amenés à poser une indication d’endartériectomie
carotidienne. Ce d’autant que les sténoses carotides
asymptomatiques sont le plus souvent prises en charge
sans aucune expertise neurologique.
La chirurgie carotidienne :
conditions d’application
P. Niclot*
Service de neurologie,
hôpital Bichat, Paris.
Plate-Forme

braux postopératoires, il n’y a pas de rai-
son d’envisager ce dépistage avant une
chirurgie
majeure, cardiaque ou vasculaire
notamment.
En revanche, il est nécessaire d’effec-
tuer un écho-doppler cervical devant
tout accident ischémique du territoire
carotidien d’évolution favorable. En
effet, les données cliniques sont trop peu
sensibles pour restreindre le dépistage de
la sténose à une fraction des patients (6).
Cette recherche doit se faire dans la
population de patients pour laquelle le
bénéfice de la chirurgie carotidienne a
été démontré : âge inférieur à 80 ans,
absence de défaillance viscérale, de
démence et infarctus cérébral n’entraî-
nant pas de dépendance dans la vie quo-
tidienne. Concrètement, les patients
inclus dans les essais avaient une espéran-
ce
de vie de 5 ans (7).
La mise en évidence d’une sténose
carotidienne repose sur l’exploration
ultrasonore associant doppler continu,
échographie et doppler pulsé couleur. La
conjonction de ces examens permet de
détecter les sténoses avec une excellente
sensibilité : un doppler continu normal
exclut la présence d’une sténose supé-
rieure à 60 %.
Comment mesurer
une sténose carotidienne ?
L’ e xploration ultrasonore, en couplant
les informations hémodynamiques du
doppler continu et morphologiques (rap-
port de surface) de l’échographie, per-
met
de mesurer le degré de sténose de
manière
précise. Cependant, les résultats
dépendent de l’examinateur, et certaines
situations (sténoses calcifiées, bifurca-
tion carotidienne haute, sténose pseudo-
occlusive…) conduisent à des difficultés
d’interprétation. Pour ces raisons, il est
nécessaire de coupler aux ultrasons
une autre exploration non invasive :
imagerie par résonance magnétique en
temps de vol ou après injection de gado-
linium, angio-scanner hélicoïdal.
La concordance des deux méthodes per-
met d’apprécier au mieux le degré de sté-
nose. Concrètement, cette stratégie
nécessite de bien connaître les divers
intervenants effectuant les examens et de
tenir compte des limites de ces explora-
tions : les sténoses pseudo-occlusives
peuvent être prises pour des occlusions,
aussi bien par l’écho-doppler que par
l’angiographie par résonance magnétique
(8) ; les sténoses de sévérité moyenne
(environ 70-80 %) sont celles où la repro-
ductibilité interobservateur de la mesure
est la moins bonne (9), et ce pour toutes
les méthodes radiologiques : on risque
alors, en cas de surestimation du degré de
sténose, de poser à tort une indication
opératoire (voir infra). Dans cette situa-
tion, comme lorsque les explorations sont
discordantes, force est de recourir à l’an-
giographie intra-artérielle si l’on est cer-
tain de faire une endartériectomie en cas
de sténose serrée. Celle-ci exposant à un
risque de 1 % de complications neurolo-
giques ne doit donc plus être systéma-
tique. Mieux vaut adresser le patient à
une équipe disposant des explorations
non invasives que faire
d’emblée une
angiographie intra-artérielle, p
arce qu’elle
seule est disponible sur place.
Sur quels critères envisager
l’endartériectomie pour une
sténose carotidienne sympto-
matique ?
Les résultats finaux des études NASCET
et ECST montrent que l’on peut séparer
les patients en trois groupes, selon leur
degré de sténose :
– les sténoses supérieures à 85-90 %
(selon la méthode de mesure européen-
ne)
confèrent un risque d’infarctus
cérébral d’environ 25 % à deux ans, ce
qui permet, lorsque le risque chirurgi-
cal est inférieur à 6-7 %, de prévenir un
infarctus cérébral pour 6 patients opé-
rés. Dans ce groupe de patients, le
bénéfice existe chez l’homme et chez la
femme, que l’accident ischémique soit
rétinien ou cérébral, transitoire ou
constitué (7, 10) ;
–
les sténoses “intermédiaires”, comprises
entre 70-75 % et 85-90 %, confèrent un
risque nettement plus faible d’infarctus
cérébral, estimé à 22 % à 5 ans (11, 12).
Lorsque le risque chirurgical est infé-
rieur à 6-7 %, il est nécessaire d’opérer
15 patients pour prévenir un infarctus
cérébral à cinq ans. Le bénéfice de la
chirurgie est donc moindre. De plus, il
n’est pas retrouvé chez tous les patients :
les femmes et les sujets ayant présenté un
accident rétinien ne bénéficient plus de
l’intervention ;
– les sténoses de degré inférieur à 70-
75 % ne doivent pas être opérées, la chi-
rurgie n’apportant aucun bénéfice par
rapport au traitement médical.
Les trois éléments essentiels permet-
tant d’évaluer le risque spontané d’in-
farctus cérébral sont donc le degré de
sténose, le sexe du patient et le type
d’accident ischémique. Dans le groupe
des sténoses supérieur à 85-90 %, de
multiples facteurs de risque ont été éva-
lués au cours d’une analyse pré-spécifiée
de l’essai NASCET : sexe masculin, âge
supérieur à 70 ans,
hypertension artériel-
le,
tabagisme, diabète, hyperlipidémie,
coronaropathie, insuffisance cardiaque,
aspect “ulcéré” de la sténose à l’angio-
graphie, sténose supérieure à 90 %, acci-
dent ischémique datant de moins de 30
jours, enfin caractère constitué de l’acci-
dent ischémique. Lorsque, au plus, 5 de
ces facteurs sont présents, le risque d’in-
farctus cérébral est seulement de 17 % à
deux ans, alors qu’il atteint 39 % lorsque
7facteurs ou plus sont retrouvés (7).
Act. Méd. Int. - Neurologie (4) n° 1, janvier 2002 136
plate-forme
Plate-Forme

Pour les sténoses “intermédiaires”, un
accident ischémique constitué et non
transitoire est associé à un plus grand
bénéfice de la chirurgie (12). De nom-
breuses analyses secondaires se sont atta-
chées à individualiser d’autres facteurs
susceptibles d’augmenter le risque d’in-
farctus cérébral. Comme elles ont été
effectuées a posteriori, elles n’ont de
valeur qu’indicative et ne sont pas
détaillées.
Quel est le taux de complica-
tions postopératoires et quels
sont leurs facteurs de risque ?
Dans les essais NASCET et ECST, le
risque de décès ou d’accident vasculaire
cérébral postopératoire était de 6,5 et
7,5 %, soit deux à trois fois plus élevé
que dans les essais consacrés aux sté-
noses asymptomatiques : le premier fac-
teur de risque de complications opéra-
toires est le caractère symptomatique
de la sténose. Les autres facteurs de
risque identifiés avec certitude sont la
nature cérébrale et non rétinienne de
l’accident ischémique et la présence
d’une occlusion carotidienne controlaté-
rale (13, 14). Ces deux facteurs augmen-
tent également le risque d’infarctus céré-
bral sous traitement médical et n’aident
donc guère à prendre une décision.
D’autres facteurs, bien que plausibles, ne
font pas l’objet d’un consensus, car ils
n’ont pas été mis en évidence dans toutes
les études : le sexe féminin, l’âge supé-
rieur à 75 ans, une artériopathie des
membres inférieurs (13), une hypodensi-
té au scanner (14). Enfin, un facteur
majeur n’est pas apparent dans les essais,
l’expérience de l’équipe chirurgicale,
bien mis en évidence par les études de
faisabilité, où l’augmentation du volume
d’actes par chirurgien et par centre est
associée à une baisse du risque de com-
plications (15).
Le risque de complications cardiaques a
été minimisé par le respect des contre-
indications : dans l’essai NASCET, un
angor instable, un infarctus du myocarde
de moins de 6 mois, une insuffisance
cardiaque non équilibrée, une hyperten-
sion non équilibrée étaient des contre-
indications temporaires à l’endartériecto-
mie (16).
Que faire lorsque le patient
ne remplit pas l’ensemble des
critères d’inclusion des essais ?
Le respect de l’ensemble des critères
d’inclusion et d’exclusion des essais est
indispensable pour opérer les patients à
haut risque d’infarctus cérébral tout en
minimisant le risque opératoire.
L’ensemble des études de faisabilité réali-
sées depuis la publication des essais ran-
domisés a montré que leur non-respect
exposait à un risque accru de complica-
tions (17). En présence de comorbidités
sévères, une intervention périlleuse dans
un but de prévention à long terme est
hautement discutable. Plutôt que se fon-
der sur les progrès de l’anesthésie et de la
chirurgie (progrès certains, mais dont
l’impact sur la morbi-mortalité postopé-
ratoire n’est pas formellement démontré)
pour décider d’une opération, il vaut
mieux se rappeler que les niveaux de
risque d’infarctus cérébral cités plus haut
ont été observés chez des patients rece-
vant pour tout traitement de l’aspirine et
éventuellement un anti-hypertenseur.
Les progrès spectaculaires réalisés dans
les traitements de l’athérosclérose (anti-
plaquettaires, statines, inhibiteurs de
l’enzyme de conversion) laissent penser
que le risque d’infarctus cérébral peut
être, aujourd’hui, notablement diminué
par le traitement médical, ce qui permet
de surseoir à une intervention hasardeuse.
Une surveillance neurologique sous un
traitement médical “maximal” est certai-
nement préférable à la réalisation d’une
angioplastie carotidienne qui, dans l’état
actuel des choses, est un acte non validé
réservé à la recherche clinique.
Quand opérer une sténose
symptomatique ?
Il n’existe pas de réponse précise à cette
question pourtant capitale, les essais thé-
rapeutiques ayant randomisé les patients
tardivement après l’accident ischémique
(30 à 40 jours en moyenne) ne sont ici
d’aucun secours. Le risque de récidive
d’infarctus cérébral étant maximal dans
le mois suivant l’événement initial, la
réponse de bon sens est d’opérer le plus
tôt possible. Concrètement, cela signifie
en urgence (dans les 24 heures) en cas
d’AIT crescendo et très rapidement en
cas d’AIT isolé. En revanche, il n’y a pas
de consensus lorsqu’il existe un déficit
constitué avec hypodensité au scanner.
En cas de rupture de barrière hémato-
encéphalique, il est habituel de contrôler
sa disparition par un scanner réalisé
après quelques semaines avant d’interve-
nir. Certains proposent une opération
plus précoce, lorsque l’hypodensité est
peu étendue et la rupture de barrière
minime ou absente. La présence d’un
thrombus mural en regard de la sténose
n’est pas une contre-indication opératoi-
re : au contraire, sa présence, étant asso-
ciée à un risque accru d’infarctus céré-
bral à court terme, incite à opérer rapide-
ment.
Et les sténoses
asymptomatiques ?
Dans cette indication, la chirurgie a été
évaluée et trouvée efficace dans un seul
essai, pour les sténoses supérieures à
Act. Méd. Int. - Neurologie (4) n° 1, janvier 2002 137
plate-forme
Plate-Forme

Act. Méd. Int. - Neurologie (4) n° 1, janvier 2002 138
plate-forme
80 % (méthode européenne de mesure)
(18). Le risque d’infarctus cérébral
homolatéral à la sténose étant de 2-3 %
par an, il faut opérer 20 patients pour
prévenir un infarctus cérébral à 5 ans. Le
bénéfice est modeste, puisqu’il n’existe
pas de diminution des infarctus invali-
dants. De plus, son application est res-
treinte, puisque les femmes, qui ont un
risque d’infarctus cérébral plus faible et
un risque opératoire plus élevé, ne reti-
rent pas de bénéfice de la chirurgie. En
dehors du sexe masculin, aucun facteur
augmentant le risque d’infarctus cérébral
n’a été identifié. Enfin, ces résultats ont
été obtenus grâce à une morbi-mortalité
postopératoire inférieur à 3 % ; ce taux
très faible n’a pas été reproduit au cours
des études prospectives ultérieures.
Ces limites expliquent que l’intérêt de la
chirurgie des sténoses asymptomatiques
est très discuté (2) et qu’un autre essai
soit en cours (ACST), dont les résultats
sont attendus pour 2004. Ces incertitudes
doivent être clairement exposées au
patient adressé en vue d’une intervention
dans cette indication.
Quel traitement médical
prescrire ?
Le traitement médical des patients por-
teurs d’une sténose carotidienne n’est
pas spécifique et repose sur la correction
des facteurs de risque et les antiplaquet-
taires. La seule restriction concerne les
sujets ayant une sténose sévère avec
retentissement hémodynamique intracrâ-
nien pour lesquels l’équilibration de la
pression artérielle n’est pas optimal, afin
d’éviter un accident ischémique hémo-
dynamique.
En cas de sténose symptomatique, l’aspi-
rine est le traitement de première inten-
tion en attente de la chirurgie. Faut-il le
remplacer par (ou lui adjoindre) de l’hé-
parine ou une héparine de bas poids
moléculaire ? Il n’existe pas de réponse à
cette question, qui demande à être étayée
par des essais randomisés.
Références
1. Hanckey GJ et al. Treatment and seconda-
ry prevention of stroke : evidence, costs, and
effects on individuals and populations.
Lancet 1999 ; 354 : 1457-63.
2. Barnett HJM et al. Do the facts and
figures warrant a 10-fold increase in the
performance of carotid endarterectomy on
asymptomatic patients ? Neurology 1996 ;
46 : 603-8.
3. Ferro JM et al. Diagnosis of transient
ischemic attacks by the non-neurologist. A
validation study. Stroke 1996 ; 27 : 2225-9.
4. Chaturvedi S et al. Does the neurologist
add value to the carotid endarterectomy
patient ? Neurology 1998 ; 50 : 610-3.
5. Rothwell PM et al. A systematic review of
the risks of stroke and death due to endarte-
rectomy for symptomatic patients. Stroke
1996 ; 27 : 260-5.
6. Mead GE et al. Can simple clinical features
be used to identify patients with severe caro-
tid stenosis on doppler ultrasound ? J Neurol
Neurosurg Psych 1999 ; 66 : 16-9.
7. NASCET Collaborators. Beneficial effect of
carotid endarterectomy in symptomatic
patients with high-grade carotid stenosis. N
Engl J Med 1991 ; 325 : 445-53.
8. Steinke W et al. Power doppler imaging of
carotid artery stenosis. Comparison with
color flow imaging and angiography. Stroke
1997 ; 28 : 1981-7.
9. Patel MR et al. Preoperative assessment of
the carotid bifurcation. Can magnetic reso-
nance angiography and duplex ultrasonogra-
phy replace contrast arteriography ? Stroke
1995 ; 26 : 1753-8.
10. European Carotid Surgery Trialists
Collaborative Group. MRC European
Carotid Surgery Trial : interim results for
symptomatic stenosis patients with severe
(70-99 %) or with mild (0-29 %) carotid ste-
nosis. Lancet 1991 ; 337 : 1235-43.
11. European Carotid Surgery Trialists
Collaborative Group. Randomized trial of
endarterectomy for recently symptomatic
carotid stenosis : final results of the MRC
European Carotid Surgery Trial (ECST).
Lancet 1998 ; 351 : 1379-87.
12. NASCET Collaborators. Benefit of carotid
endarterectomy in patients with symptomatic
moderate or severe stenosis. N Engl J Med
1998 ; 339 : 1415-25.
13. Rothwell PM et al. Clinical and angiogra-
phical predictors of stroke and death from
carotid endarterectomy : systematic review.
BJMJ 1997 ; 315 : 1571-7.
14. Ferguson GG et al. The North American
Symptomatic Carotid Endarterectomy Trial :
surgical results in 1 415 patients. Stroke
1999 ; 30 : 1751-8.
15. Hannan EL et al. Relationship between
provider volume and mortality for carotid
endarterectomies in New York state. Stroke
1998 ; 29 : 2292-7.
16. Paciaroni M et al. Medical complications
associated with carotid endarterectomy. North
American Symptomatic Carotid Endarterectomy
Trial. Stroke 1999 ; 30 : 1759-63.
17. Wong JH et al. Improving the appropriate-
ness of carotid endarterectomy. Results of a
prospective city-wide study. Stroke 1999 ;
30 : 12-5.
18. Executive Committee for the
Asymptomatic Carotid Atherosclerosis Study.
Endarterectomy for asymptomatic carotid
stenosis. JAMA 1995 ; 273 : 1421-8.
Plate-Forme
1
/
4
100%