– UE : 7

2016-2017 Biologie cellulaire et moléculaire
Biologie cellulaire et moléculaire
– UE : 7
Prolifération et apoptose contrôle du cycle cellulaire
Semaine : n°17 (du 30/01/17 au
03/01/17)
Date : 01/02/2017
Heure : de 15h00 à
16h00 Professeur : Pr. Paumelle
Binôme : n°9 Correcteur : n°38
Remarques du professeur : diapo disponible sur Moodle
PLAN DU COURS
I) Destin cellulaire physiologique et pathologique
II) Les protéines de régulation du cycle cellulaire
A) Les complexes cycline/CDK
1) Définition
2) rôle
B) Régulation des cyclines
1) Synthèse
R
RÉGULATION
ÉGULATION
TRANSCRIPTIONNELLE
TRANSCRIPTIONNELLE
R
RÔLE
ÔLE
DES
DES
FACTEURS
FACTEURS
DE
DE
CROISSANCE
CROISSANCE/
/MITOGÈNES
MITOGÈNES
2) Dégradation
R
RÉGULATION
ÉGULATION
POST
POST-
-TRADUCTIONNELLE
TRADUCTIONNELLE
P
PHOSPHORYLATION
HOSPHORYLATION,
, UBIQUITINYLATION
UBIQUITINYLATION
3) Localisation
R
RÉGULATION
ÉGULATION
POST
POST-
-TRADUCTIONNELLE
TRADUCTIONNELLE
PHOSPHORYLATION
PHOSPHORYLATION
C) Régulation des CDK
1) Activité
2) liaison aux cyclines
III) Les points de contrôle du cycle cellulaire
A) La transition G1/S
B) La transition G2/M
C) La transition métaphase-anaphase
1/13

2016-2017 Biologie cellulaire et moléculaire
(Suite de cours)
II) Les protéines de régulation du cycle cellulaire
B) Régulation des cyclines
R
RÔLE
ÔLE
DES
DES
FACTEURS
FACTEURS
DE
DE
CROISSANCE
CROISSANCE/
/MITOGÈNES
MITOGÈNES
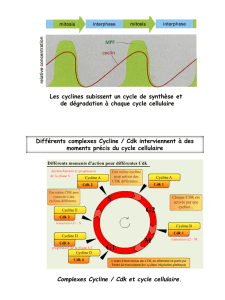
A la sortie de la mitose, l'entrée dans le cycle cellulaire dépend de la présence de facteurs de croissance/
mitogènes
Les facteurs mitogènes sont important pour l'entrée des cellule dans le cycle.
Expérience avec des cellules synchronisées : Si on élimine les facteurs mitogènes, à quel moment le cycle est
bloqué ?
On prends des cellules en phase G1 avec et sans facteurs mitogènes, (idem avec la phase S et G2) :
–En phase G1 sans facteurs mitogènes la cellules arrête sa progression dans le cycle cellulaire et entre en
phase G0 = phase de quiescence. La cellule restera en phase G0 sans facteur mitogène.
les facteurs mitogènes sont nécessaire en phase G1 pour permettre de déclencher l'entrée des cellules
dans le cycle cellulaire, et permettre un cycle complet.
–Quand on rajoute aux cellules en phase G0 des facteurs mitogènes, les cellules vont de nouveau rentrer
dans un cycle cellulaire.
L'ajout de facteurs mitogènes ne doit pas se faire sur un temps court !
Pour que les cellules passent le point de contrôle R = point de restriction,il faut une présence de facteur
mitogène pendant 8h
Point R : point de décision (point de restriction) d'entrée de la cellule dans un cycle cellulaire complet.
Remarque: Après passage du point de restriction (R) il n'est plus nécessaire d'avoir des facteurs mitogènes.
Autrement dit si dans notre expérience on enlève les facteurs mitogènes (après que la cellule a passé le point de
restriction) cela n'aura pas d'impact sur le cycle.
Pourquoi 8h de présence de facteur mitogène
?
Nécessite de la synthèse protéine (long), temps que les gènes soient transcrit, que l'ARNm mature et traduction en
protéine.
Le retour dans le cycle cellulaire nécessite du temps (8h)
2/13

2016-2017 Biologie cellulaire et moléculaire
Expérience avec cycloheximide :
–On met des facteurs mitogènes + cycloheximide on constate que l'on reste en phase G0, ainsi la cellule
n'est pas capable de dépasser le point de restriction (car ajout d'inhibiteur)
Le retour dans le cycle cellulaire est inhibé par la cycloheximide
=> le retour dans le cycle cellulaire nécessite donc une synthèse protéique.
Facteur mitogène
:
Agissent en fonction de leur nature (polaire ou apolaire), sur des récepteurs membranaires ou nucléaires, pour
conduire à l'activation de l'expression des gènes
•Facteurs de croissance : EGF, FGF, NGF, PDGF, IGF1
•hormones peptidiques activant des récepteurs membranaires : Insuline, FSH, LH, ACTH, AT2
•cytokines : Érythropoïétine (EPO), interleukines (interféron γ), hormone de croissance
•hormones stéroïdiennes (œstrogènes, cortisol,...) et thyroïdiennes (T3, T4) pénétrant dans la cellule et
activant des récepteurs nucléaires
Rôle des facteurs mitogènes :
•facteurs de croissance
•hormones peptidiques activant des récepteurs membranaires
•cytokines
•hormones stéroïdienne et thyroïdiennes pénétrant dans la cellule et activant des récepteurs nucléaires
Conséquences
:
activation de gènes par transduction de signal
activation directe des gènes par les récepteurs nucléaires
Une centaine de gènes activés
:
Activation de la synthèse protéique
Cycline D puis Cycline E
Quand une cellule est en présence de facteur mitogène, ce dernier se
fixe sur un récepteur (ici récepteur tyrosine kinase) cela conduit à
l'activation de RAS via le facteur GES, RAS va venir activé MAP
kinase et conduit à l'activation de gènes régulateur de protéine. Cela va
induire l'expression d'un gène qui est lui même un facteur de
transcription : MYC, qui va induire expression d'autre gène EX :
cycline D et conduire à l'activation cycline G/CDK
Ce sont des transcriptions de gène en cascade suite à l'incubation des
cellules avec les facteurs mitogènes
Présence de gènes précoce exprimé très rapidement. Dès 3-4h on peut
les mesurer, alors que cycline D prends plus de temps, car pour
l'induction de ce facteur il faut déjà induction de son précurseur.
3/13

2016-2017 Biologie cellulaire et moléculaire
Vague successive d'activation pour conduire à l'activation cellulaire
Une fois que la cycline D est exprimée (environ 8h), il va se former le complexe cycline D/CDK. Ce complexe va
venir phosphorylé la protéine de rétinoblastome et ainsi rendre le facteur E2F libre et actif.
Le facteur E2F va venir induire l'expression de gène lors de la phase S et activer les cyclines.
La cycline E et la cycline A couplé à la CDK vont venir faire un rétrocontrôle positif sur l'activation du facteur
E2F
Rétro contrôle : cycline S actif va favoriser l'action de E2F, temps que la phase S se déroule, rétro contrôle pour
être sur que la phase S se déroulement correctement
Les facteurs mitogènes vont induire l'expression de toutes les cyclines de façon directe ou indirecte
2) Régulation de leur dégradation :
PHOSPHORYLATION
PHOSPHORYLATION,
, UBIQUITINYLATION
UBIQUITINYLATION,
, PROTÉASOME
PROTÉASOME
Les cyclines vont être régulé par dégradation, qui nécessite des événements de : phosphorylation, ubiquitinylation
et dégradation par protéasome
Pour la cycline B CDK1 (de la phase M) : au moment où il va y avoir séparation des chromatines sœurs
(anaphase), cela va déclencher la phosphorylation de la cycline B (ou M) au niveau d'un résidu thréonine, qui va
déclencher son programme de dégradation.
Cela ce fait uniquement au moment de l'anaphase
!
4/13

2016-2017 Biologie cellulaire et moléculaire
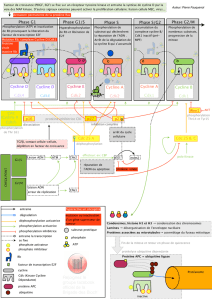
Explication : la phosphorylation va permettre la reconnaissance par APC, qui contient une activité ubiquitine
lyase ; APC va greffer résidu ubiquitine (sur la cycline) ce qui correspond à un signal d'adressage des protéines
vers le protéasome pour être dégradé. Ainsi la cycline B sera dégradé par le protéasome.
Rappel : polyubiquitinylation = signal adressage de la protéine vers le protéasome.
Pour que APC permettre de poly ub la cycline, il faut que APC soit activé. L'APC est activé par une sous unité
Cdc20 (APC est activé au moment de la mitose)
Expérience
: Comment savoir qu'elle est bien dégradé par ubiquitinylation ?
Il va falloir purifier la cycline B.
–Synchroniser les cellules : essayer de récupérer des extraits protéiques en prophase, en métaphase, …
on récupère des extraits protéiques au cours du temps
–on va purifier la cycline B avec un anticorps (AC) anti cycline B : l'AC est lié a des billes. =
immunoprécipitation
–on lave ensuite les billes, ce qui reste accroché = les protéines associé au AC
–on pose ensuite sur un gel polyacrilamide, puis transfère sur une membrane microcellulose puis révélation
par des AC anti cycline B. (révélation de l'ubiquitine par le même système : AC anti ubiquitine)
5/13
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%







![(Microsoft PowerPoint - LSV1 CM XI 16 net [Mode de compatibilit\351])](http://s1.studylibfr.com/store/data/001219303_1-c93358a33819374b37626757f18c51e2-300x300.png)

