07 12 16 9h 10h glyco conjugues briand

2016-2017 Glyco-conjugués et pathologies associées
Biochimie
– UE VII: – Sciences biologiques
Glyco-conjugués et pathologies associées
Semaine : n°14 (du 05/12/16 au
09/12/16)
Date : 07/12/2016
Heure : de 9h00 à
10h00 Professeur : Pr. Briand
Binôme : n°60 Correcteur : n°65
Remarques du professeur
• Diapos disponibles sur Moodle
PLAN DU COURS
I) Introduction
II) Diversité des glycoconjugués
III) Glycosylation des lipides
IV) Quelques fonctions des glycosphingolipides
V) Glycosylation des protéines
A) Quelques fonctions associées à la glycosylation des protéines
B) Principaux modes de glycosylation des protéines
C) Diversité des N-glycanes
VI) Diversité des oligosaccharides O-liés
A) Mucines ( O-glycanes)
B) Protéines O-glycosylées ( autres que mucines)
VII) Protéoglycanes
A) Analogie Héparane Sulfate / Héparine
B) Quelques fonctions de protéoglycanes
VII) Processus enzymatiques mutations = maladies
VIII) Exemples de pathlogies
1/10

2016-2017 Glyco-conjugués et pathologies associées
I) Introduction
Les sucres sont des éléments structuraux qui entrent dans la composition de la famille des
glycoconjugués qui , sont des assemblages de motifs glycaniques à des protéines, à des lipides et qui
constituent une famille extrêmement vaste des composants de la MEC, des membranes des cellules que
l’on trouve dans tous les règnes vivants ( règne eucaryote, des levures et champignons, jusqu’aux
vertébrés).
Ce cours a pour but de nous montrer la diversité de ces glycoconjugués.
On a une très grande variété de glycoconjugués.
Les structures qui sont composées d'un nombre limité d'unités d'oses (9 sucres différents) vont entrer
dans la composition des glycoconjugués.
II) Diversité des glycoconjugués
La glycosylation est le processus global qui permet la formation de ces glycoconjugués. Elle fait
intervenir une collection d'enzymes qui se trouvent dans les compartiments sécrétoires (appareil de golgi
et RE) .
Une collection limitée (1 à 2% du génome) est utilisée pour coder ces enzymes pour amener à la
modification d'un grand nombre de protéines et de lipides que l'on trouve dans la membrane des cellules.
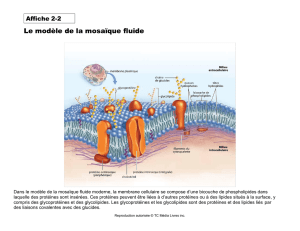
Ceci une photo au ME de la surface d'une cellule de mammifère avec un glycocalyx qui est un manteau
dense aux électrons que portent toutes les cellules. Il est constitué de glycoconjugués.
La glycosylation amène à la formation de différents types de GC.
Plusieurs grandes familles, de types de GC se forment dans l'organisme .
Les GC qui sont composés de N-glycanes liés à l'asparagine de protéines se trouvent dans la plupart des
protéines des membranes . On trouve des glycanes liés aux protéines au niveau d'un résidu serine-
thréonine, ce sont les O-lipide-glycanes qui présentent eux aussi une certaine diversité.
Ce qui prédomine dans les GC sont les mucines qui sont secrétées, ils sont à la membrane des
épithéliums et des cellules cancéreuses .
On a aussi les protéoglycanes dont la partie glycanique est composée de glycosaminoglycane (GAG).
Les GAG existent à l’état libre dans la cellule vivante (acide hyaluronique) et aussi sous la forme liée à
une serine (donc appartenant à une protéine membranaire ou sécrétée).
Les protéoglycanes sont des GC qui résultent de l'assemblage sur une protéine d'un nombre variable de
GAG à liaison O-glycanique sur une serine essentiellement.
On a une grande diversité de GAG.
Les GAG principaux sont l'héparane sulfate et la chondroïtine sulfate.
On trouve des GC qui résultent de la condensation de motif glycannique sur des lipides : famille des
2/10

2016-2017 Glyco-conjugués et pathologies associées
glycosphyngolipides où le motif glycannique est de petite taille et lié à un céramide : phospholipide
membranaire formé de sphingosine et d'un AG.
Une autre famille de GC : protéine liée à la membrane par un ancrage de type GPI
(glycosylphosphatidylinositol). Ce motif glycannique assure le lien entre la protéine et la membrane
cellulaire.
A côté de ces GC qui sont soit ancré à la membrane soit sécrétés (qui sont retrouvés dans les liquides
extracellulaires comme le plasma ,liquides articulaires, le milieu interstitiel), un petit nombre de cas de
glycosylation concernent des protéines cytosoliques et nucléaires, on parle de proglucosylation qui est
une modification post-traductionnelle et qui touche des facteurs de transcription, des récepteurs
nucléaires, des ADN polymérases et qui consiste en l'ajout d'un motif unique GlcNAc (N-acetyl
glucosamine sur un sucre habituellement phosphorylé). Il intervient une modification post-
traductionnelle réversible qui met en jeu des enzymes (O-GlcNAcyl transferase et les O-GlcNAcase
qui permettent l'ajout et le retrait de ce motif O-GlcNAc aux protéines du cytosol et du noyau ).
Hormis ce cas particulier de la glycosylation des proteines cytosoliques et nucléaires, la glycosylation en
générale concerne des protéines qui sont à la membrane et qui sont sécrétées .
Ces motifs glycaniques vont jouer des rôles importants dans le caractère antigénique des cellules, dans
les processus de signalisation, d'adhérence cellulaire (lectine) et dans la motilité des cellules (diapédèse /
rolling).
III) Glycosylation des lipides
La glycosylation des lipides est un processus qui se déroule dans le Golgi et qui amène à la formation des
gangliosides. C'est un processus qui consiste en la glycosylation du céramide (lipide membranaire) qui
est glycosylé par un petit nombre de motifs glycanique (6 oses) pour former des cérebrosides ou des
globosides (nombre important de motif osidique).
Les cérébrosides et globosides jouent un rôle particulièrement important dans la peau pour assurer son
imperméabilité. On en trouve aussi dans le système nerveux.
On parle aussi de cérébrosides lorsqu'ils ont en plus un résidu osidique acide particulier qui est l'acide
sialique ( motif osidique acide qui donne aux GC le caractère acide chargé négativement à la surface
des cellules).
Les gangliosides sont abondants dans le système nerveux central c'est une grande famille de GC
lipidiques ( glycosphingolipides) .
IV) Quelques fonctions des glycosphingolipides
Constituant des membranes cellulaires (feuillet exoplasmique).
Association avec le cholesterol dans les rafts (radeau lipidique).
Ce sont des motifs antigéniques des surfaces cellulaires (ABO).
Ils sont la cible de vaccination due au fait qu'ils soient antigéniques. Ils jouent un rôle aussi dans certains
cancers. Ce sont des constituants des gaines de myéline et participent donc à la conductance électrique.
3/10

2016-2017 Glyco-conjugués et pathologies associées
V) Glycosylation des protéines
Il y a deux grandes catégories de GC protéiques : les glycoprotéines et mucines d'une part et les
protéoglycanes d'autre part.
Les glycoprotéines et mucines résultent d'association sur une protéine d'une chaine oligosaccharidique,
parfois plusieurs. Ce sont des chaines relativement courtes par rapport aux protéoglycanes. Ce sont des
structures souvent branchées. Et c'est la marque de presque toutes les protéines membranaires, mais aussi
des protéines du lysosome, RE, golgi, organites intracellulaires du compartiments sécrétoires. Ce sont
aussi des constituants des milieux extracellulaires.
Les protéoglycanes sont aussi des GC protéiques. Les motifs glycaniques (GAG) sont des chaines très
longues (100 de motifs glycaniques), linéaires et fortement chargées négativement (présence de sulfates
et de molécule d'acide uronique). Les protéoglycanes sont des constituants majeurs des MEC des os,
tissus conjonctifs, cartilages, cornée et liquides articulaires.
A) Quelques fonctions associées à la glycosylation des protéines
La glycosylation des protéines participe à la maturation, solubilité et recyclage des protéines.
C'est un processus qui participe aussi au trafic des protéines. Il permet aussi l'adressage aux
compartiments (organites, membranes, sécrétion).
Les GC participent à la signalisation cellulaire car les protéoglycanes jouent le rôle de co-récepteur pour
des facteurs de croissance sécrétés par des cellules cancéreuses.
Les GC ont un rôle dans les interaction / trafic cellulaire. Les lectines reconnaissent les motifs
glycaniques. Ce sont des protéines exprimées par les cellules de l'endothélium vasculaire (E-sélectine),
les leucocytes (L-sélectine) et les plaquettes (P-sélectine). Ces protéines ont la capacité de reconnaître
des motifs glycaniques exprimés par l'homme aux partenaires cellulaires (glycoprotéines membranaires,
mucines...)
Les lectines sont donc importantes dans les phénomènes inflammatoires et aussi cancéreux.
4/10

2016-2017 Glyco-conjugués et pathologies associées
B) Principaux modes de glycosylation des protéines
• N-linked glycosylation : la chaîne glycanique est liée à un résidu Asparagine de la protéine. Processus
initié dans le RE de toutes les cellules.
–Protéines lysosomales, membranaires, secrétées
• O-linked glycosylation : un oligosaccharide est lié à l’hydroxyl d’un résidu Ser ou Thr d'une protéine.
Processus initié dans le Golgi.
–Mucines ++ , protéoglycanes, (autres protéines membranaires et secrétées)
• GPI-linked (Glypiation) : une chaîne oligosaccharidique lie un phospholipide à une protéine (ancrage
GPI).
C) Diversités des N-glycanes
On rencontre des N-glycanes très diverses avec certains riches en mannose. Ils sont complexes et ont des
formes diverses mais ils ont tous en commun un motif à 5 résidus osidiques formés de N-acétyl
glucosamine et de 3 mannoses.
Ils sont liés par leurs extrémités réductrices à une asparagine. Et selon la composition de leurs
extrémités non réductrices (au niveau des antennes), on parlera de N-glycane riche en mannoses quand
les 2 antennes ont un mannose supplémentaire, hybrides quand une des antennes a un mannose
supplémentaire ou motifs complexes quand aucune des antennes sera formée de mannose
supplémentaire mais sera formée d'un motif lactose.
La caractéristique aussi des N-glycanes est la présence d'acides sialiques pour les N-glycane complexe et
la présence d'oses neutres supplémentaires comme le fucose.
Cette diversité des glycanes s'explique par le mode d'élaboration (dans le golgi et RE) et c'est un
processus qui fonctionne selon un mode séquentiel ordonné en effet il y a des enzymes qui interviennent,
elles sont de 2 types : des glycosyl transferase qui élaborent le motif glycanique, permettent sa
croissance, transfèrent des motifs glycaniques un par un et les glycosidases qui vont détacher les
glycanes un pas un.
5/10
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%