– UE 6 : Chimie organique– PLAN DU COURS

2016-2017 Acides Aminés et peptides / Dérivés polyfonctionnels
1/14
– UE 6 : Chimie organique–
Les acides aminés et peptides (fin)
Les dérivés polyfonctionnels (début)
Semaine : n°4 (du 26/09/16 au
30/09/16)
Date : 26/09/2016
Heure : de 8h00 à
10h00 Professeur : Pr. Flipo
Binôme : n°62 Correcteur : n°66
Remarques du professeur : Diapos disponibles sur Moodle, dernier cours de ce professeur
PLAN DU COURS
(Suite du cours précédent sur les acides aminés)
IV. Structure des protéines
A) Séquençage des protéines et détermination de la structure primaire
B) Structure secondaire
C) Structure tertiaire
1) Ponts disulfures
2) Les interactions de stabilisation
D) Dénaturation des protéines
Les dérivés polyfonctionnels
I. Les dérivés carbonylés α-β insaturés
A) Structure et réactivité des alcènes
et des carbonyles
B) Les diènes conjugués
1) Structure
2) Nomenclature
3) Condensation aldolique
C) Réaction avec les électrophiles
1) Addition des hydracides sur les
diènes
2) Addition des hydracides sur les
dérivés carbonylés α-β insaturés
D) Réaction avec les nucléophiles
1) Réaction avec les nucléophiles forts
2) Réaction avec les nucléophiles
faibles
E) Annellation de Robinson
F) Réaction avec les cystéines
G) Détoxification par le Glutathion
II. Les β-cétoesters
A) Formation par condensation de Claisen
B) Décarboxylation des acides carboxyliques
C) PKA des composé béta bicarbonylés

2016-2017 Acides Aminés et peptides / Dérivés polyfonctionnels
2/14
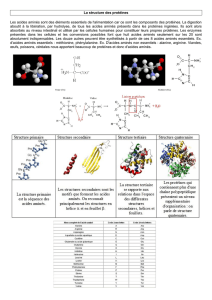
B) Structure secondaire
La structure secondaire des protéines indique la façon dont se replient les segments de la chaîne
principale d'un peptide ou d'une protéine. Il existe 2 structures secondaires caractéristiques :
L'hélice α : le squelette du polypeptide s'enroule en spirale. Les
substituants liés au carbone α des acides aminés s'orientent à l'extérieur de
l'hélice pour limiter au maximum l'encombrement stérique.
Elle est stabilisée par des liaisons hydrogènes car chaque hydrogène lié à
l'azote d'un amide va former une liaison avec l'oxygène lié au carbone situé 4
acides aminés plus loin.
Le feuillet β : le squelette du polypeptide se forme en zigzag. Les liaisons hydrogènes s'établissent entre
les chaînes peptidiques adjacentes. Les substituants -R doivent être petits pour que les chaînes se rapprochent
suffisamment afin de maximiser les interactions des liaisons hydrogènes.
La structure secondaire donne une propriété élastique différente aux protéines.
Par exemple :
–La laine ou les protéines fibreuses des muscles sont principalement sous forme d'hélice α, ce qui leur permet
d'être extensibles.
–La soie ou les toiles d'araignées, sont principalement sous forme de feuillets β, ce qui ne leur permet pas
d'être extensibles. En effet, les feuillets β sont quasiment au maximum de leur étirement et donc peu
extensibles.
Moins de la moitié du squelette des protéines prend une structure secondaire définie. Le reste n'a pas de structure
secondaire définie.
C) Structure tertiaire
C'est la disposition tridimensionnelle de tous les atomes de la protéine.
Dans une solution, les protéines vont se replier spontanément pour maximiser leur stabilité. On trouve ainsi :
•Des liaisons covalentes : liaisons peptidiques et pont disulfures entre 2 cystéines,
•Des liaisons non covalentes : liaisons hydrogènes, électrostatiques ou hydrophobes.
1) Ponts disulfures
On les trouve entre 2 résidus thiols. L'oxydation d'un thiol dans des conditions douces produit un pont disulfure =
liaison soufre-soufre. La cystéine possède des liaisons thiol au bout et peut s’oxyder.
Ils participent à la forme globale d'une protéine en unissant des résidus de cystéines situés partout dans le
squelette peptidique.
Exemple : la kératine (présente dans les cheveux) possède beaucoup de résidus de cystéine, et ainsi beaucoup de
ponts disulfure. Ils déterminent la structure des cheveux (lisses, frisés). On peut changer cette structure en modifiant
ces ponts disulfures. On applique un agent réducteur sur les cheveux, ça réduit tous les ponts disulfures, toutes les
cystéines se retrouvent sous la forme SH. On fait prendre une forme aux cheveux, et on les traite avec un agent
oxydant de façon à maintenir la forme désirée.
2) Interactions de stabilisation
Pour stabiliser la structure tertiaire, d'autres interactions de stabilisation existent :
–Des liaisons hydrogènes peuvent se former :
Entre feuillets β et hélice α,
Entre les chaînes latérales des acides aminés,
–Des interactions hydrophobes entre deux acides aminés hydrophobes
–Des interactions électrostatiques entre les acides aminés basiques et acides
IV. Structure des protéines
A) Séquençage des protéines et détermination de la structure primaire

2016-2017 Acides Aminés et peptides / Dérivés polyfonctionnels
3/14
D) Dénaturation des protéines
La structure tertiaire des protéines peut être dénaturée. Les processus pour dénaturer une protéine sont :
•Changement de pH : il modifie les charges et détruit les interactions électrostatiques ainsi que les liaisons
hydrogènes existantes.
•
Application d'urée qui va créer de nouvelles liaisons hydrogènes et perturber la structure tertiaire,
•Ajout de solvant organique qui va détruire les interactions hydrophobes,
•La chaleur et l'agitation vont détruire les forces d'attraction et donc dénaturer la protéine.
Exemple : changement du blanc d’œuf lorsqu'il est fouetté.
Les dérivés polyfonctionnels
On va voir 2 types : les dérivés carbonylés α-β insaturés et les β-cétoesters.
Les acides aminés possèdent 2 fonctions (acide carboxylique + amine), ce sont donc des polyfonctionnels.
Un polyfonctionnel est une molécule qui possède deux fonctions réactives.
I. Les dérivés carbonylés α-β insaturés
A) Structure et réactivité des alcènes et des carbonyles
Dans la structure, on trouve un regroupement entre un carbonyle (aldéhyde ou cétone) et un alcène.
1) Un alcène :
–Les alcènes ont un structure plane avec des atomes hybridés sp².
–
Les 6 atomes sont coplanaires.
–La double liaison est une région de densité électronique élevée.
–Les alcènes réagissent donc avec des électrophiles.
La double liaison riche en électron est le nucléophile qui attaque le proton. On positionne le proton de HCl sur le
CH2 pour former le carbocation le plus stable, puis Cl- attaque le carbocation.
2) Un carbonyle :
–Les carbonyles ont aussi une structure plane avec des atomes hybridés sp².
–4 atomes sont coplanaires.
–La liaison est polarisée : le carbone est déficitaire en électrons.
–Les carbonyles réagissent avec des nucléophiles. Sur le 2ème carbone, on a un H
mobile et acide en α. Il peut être arraché par une base et former un carbanion.
–On peut faire des réactions d'énolisation.
–On peut faire réagir le carbanion avec les électrophiles.
→ Le carbonyle peut réagir avec les nucléophiles et les électrophiles.
Exemple de réaction : alkylation du carbone α des composés carbonylés

2016-2017 Acides Aminés et peptides / Dérivés polyfonctionnels
4/14
Réaction d'alkylation en β du carbonyle maintenant possible.
Les carbonylés α-β insaturés s'apparentent aux diènes conjugués.
Les dérivés carbonylés α-β insaturés qui sont l'assemblage d'un alcène avec un dérivé carbonylé, peuvent former
une liaison σ.
B) Diènes conjugués
1) Structure
Diène = assemblage de 2 alcènes.
Sur un diène conjugué, on peut délocaliser les électrons dans deux
sens différents ce qui donne 2 formes mésomères (seuls les
électrons bougent) :
La liaison σ possède un caractère partiel de double liaison. Quand
on délocalise les électrons d'un côté ou d'un autre, elle devient une double liaison, il ne peut donc pas y avoir de libre
rotation autour de cette liaison σ.
On trouve 2 types de configurations possibles :
•S-trans : les doubles liaisons sont de chaque côté de la liaison
simple.
•S-cis : les doubles liaisons sont du même côté de la liaison simple.
→ Pour passer de cis à trans : on doit obligatoirement casser une
liaison car il n'y a pas de libre rotation possible.
Chez les carbonylés α-β insaturés, on ne trouve qu'une seule forme mésomère. Les électrons sont fortement
attirés vers l'oxygène qui est très électronégatif. Il devient un anion et donc on forme un carbocation. Une autre
délocalisation est possible en déplaçant les électrons vers le carbocation. Un autre carbocation est formé en β de
l'oxygène.
La liaison σ peut être :
•S-Trans :
Les doubles liaisons sont du côté opposé de la liaison σ
•S-Cis :
Les doubles liaisons sont du même côté de la liaison σ
De par le caractère partiel de la double liaison, la liaison σ est
plus courte (1,48A) qu'une liaison normale (1,54A normalement). Avec un alcène, cette liaison est encore plus
courte.
Pour les dérivés carbonylés α-β insaturés, on trouve les 8 atomes dans le même plan avec les orbitales qui permettent
un recouvrement latéral (liaison π).
Ces dérivés carbonylés α-β insaturés sont retrouvés dans différentes molécules :
–La carvone : terpène,
–L'aldéhyde cinnamique (constituant principal de la cannelle),
–Les stéroïdes (cortisol, progestérone, testostérone...).

2016-2017 Acides Aminés et peptides / Dérivés polyfonctionnels
5/14
Isomérisation des β-énones en α-énones plus stables :
Du fait de leur caractère conjugué, les α-énones
sont plus stables que les β-énones.
Lorsque les conditions sont requises, les β-énones
ont tendance à conduire aux α-énones par
isomérisation. La migration de la double liaison est
catalysée par les acides.
En milieu acide, la double liaison riche en électrons
vient chercher le H+ électrophile. H+ se positionne
de manière à former le carbocation le plus stable (=
plus substitué). Ici c'est le carbocation tertiaire.
Une fois formé, on peut faire partir un H+ :
•Soit celui que l'on vient de mettre → on revient à la structure de départ
•Soit, pour arriver à une structure plus stable, on fait partir le proton qui est du côté du O.
L'isomérisation des stéroïdes permet d'avoir une conjugaison des doubles liaisons, ce qui donne une structure plus
stable.
2) Nomenclature
On trouve une fonction aldéhyde (-al) avec alcène (-én) = énal.
On trouve une fonction cétone (-one) avec alcène (-èn) = énone.
3) Condensation aldolique
La synthèse des énals se fait par condensation aldolique.
Exemple de la synthèse de l'aldéhyde cinnamique à partir de l'acide cinnamique.
Réflexion par rétrosynthèse (on essaie de trouver les réactifs).
•On peut former la double liaison par départ d'une
molécule d'eau. On trouve donc sur le réactif une
fonction hydroxyle et 2 hydrogènes qui peuvent faire
une réaction de déshydratation.
•On peut aussi former 2 monomères : un carbone
électrophile et un nucléophile. On trouve donc dans les
réactifs un benzaldéhyde (électrophile) et un
acétaldéhyde (nucléophile).
Synthèse :
•On part de l'acétaldéhyde dans un milieu basique : la base arrache un proton sur le carbone en α du CO et
forme un nucléophile CH2-.
•On a stabilisation de la charge négative sur l'oxygène avec formation de la forme mésomère : énolate.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%