27 09 16 8h 9h biochimie tailleux

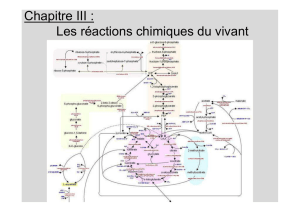
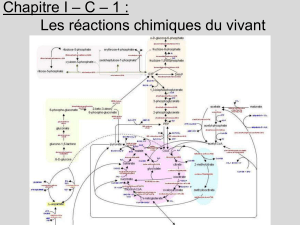
2016-2017 Métabolisme du glycogène
Biochimie
– UE VII : Sciences biologiques–
Pas d'annexe
Semaine : n°4 (du 26/09/16 au
30/08/16)
Date : 27/09/2013
Heure : de 8h00 à
09h00 Professeur : Pr. Tailleux
Binôme : n°63 Correcteur : n°
Remarques du professeur
•Diapo sur Moodle (certaine planche)
I.
PLAN DU COURS
I) GENERALITES SUR LE GLYCOGENE
A) La synthèse du glycogène
B) La dégradation du glycogène
C) Le devenir du glycogène
II)REGULATION DES VOIES DE SYNTHESE ET DE DEGRADATION
A) Régulation de la glycogène synthase
B) Régulation de la glycogène phosphorylase
1) Description générale
2) Passage de la forme phosphorylé à la forme non phosphorylé
3) Régulation allostérique
4) Régulation par la phosphorylase kinase
C) Coordination de la régulation de ces deux voies
III) LES MALADIES DE STOCKAGE DU GLYCOGENE OU
GLUCOGENOSES
A) Maladie de Von Gierke : type I
B) Maladie de Pompe : type II
C) Maladie de Cori : type III
D) Maladie de Mac Ardle : type V
1/6

2016-2017 Métabolisme du glycogène
I) GENERALITES SUR LE GLYCOGENE
Structure = glucose alpha 1→4 ramifications alpha 1→6
→ Présent dans le foie et dans le muscle
A) La synthèse du glycogène
La synthèse du glycogène est relativement simple, elle consiste à l'activation (phosphorylation) d'une molécule de
glucose, qui pourra ensuite venir se fixer a une molécule de glycogène.
Attention : La présence d'une amorce indispensable.
→ Le phénomène de branchement est assuré par la glycogène glucosidase
B) La dégradation du glycogène
=> La dégradation du glycogène est aussi appelé : glycogénolyse ++ (noms imp), cette dégradation est
relativement simple et fait appel à une phosphorylase qui va catalyser la libération d'une molécule de glucose
sous forme de Glucose-1-Phosphate par le groupement phosphore.
La molécule de glycogène qui a n résidu de glucose va être raccourci d'une unité pour données du glycogène n-1
et un Glucose-1-Phosphate (G1P).
→ Réaction de phosphorolyse par un groupement phosphate.
Cette phosphorolyse utilise un cofacteur qui est la vitamine B6.
Pour lier les unités de glucose en alpha 1→6 = enzyme débranchante qui porte deux activités enzymatique :
–Transférase
–Amylo alpha 1→6 glucosidase qui hydrolyse une liaison entre deux unités de glucose en alpha 1→6
Les choses s'organise en différentes étapes
:
→ Représentation de la molécule de glycogène
Il y a une chaîne principale plus ramification en alpha 1→6, l’extrémité à droite (sur l'image) est réductrice, car
OH anomérique libre, à gauche extrémité non réductrice car pas de OH anomérique.
Attention : Dans le glycogène il y a beaucoup plus d'extrémité non réductrice +++
•La phosphorylase va agir en libérant les unités G1P.
•Elle va agir jusqu'à arrivé à proximité d'une ramification qui porte encore 4 unités de glucose (sur l'image)
→ activité transférase de l'enzyme débranchante qui va transféré les 3 dernières molécules sur une autre
branche plus éloigné ensuite la deuxième action agit → activité amylo alpha 1→6 glucosidase qui va
libérer la molécule de glucose.
=> Libération progressive des glucoses.
La structure ramifié du glucose est importante car cela permet d'avoir présence de plusieurs extrémité non
réductrice ou peuvent être libéré des unités glucose.
Par action de la phosphorylase, qui donne 90% de G1P et 10% de glucose libre. ++
2/6

2016-2017 Métabolisme du glycogène
C) Le devenir du glycogène
Que devient le glucose et le G1P, soit dans foie soit dans le muscle ?
Le G1P devient G6P par la phosphoglucomutase, ensuite le G6P a des devenirs différents selon sa localisation :
→ Dans le muscle : le G6P rejoint directement la voie de la glycolyse qui produira de l’énergie (ATP). Évidement
le glucose libre libéré aussi par la molécule de glycogène va rejoindre aussi la glycolyse.
→ Dans le foie
: le G6P va être déphosphorylé par la gluco-6-phosphatase et va être libéré dans la circulation
sanguine, puis rejoint les organes utilisateurs le cerveau en priorité, le globule rouge et le muscle. La glycolyse
hépatique peut servir à alimenter le muscle en glucose
=> Ce glycogène sert donc pour tout les organes utilisateur de glucose. ++
Les 10% de glucose libre vont pouvoir passer directement dans le compartiment circulant par GLUT
II) REGULATION DES VOIES DE SYNTHESE ET DE DEGRADATION
→ Deux voies hautement régulées, cette régulation est bien coordonnée.
Les choses s'organise de manière logique, c'est à dire que quand la voie de synthèse est active la voie de
dégradation est inactive. C'est pareil pour toutes les cellules on ne synthétise et ne dégrade pas en même temps.
Il existe deux types de régulation :
•Régulation allostérique
•Régulation hormonale : phosphorylation réversible qui est sous le contrôle des deux hormone majeure,
- Insuline
- Glucagon
Dans le muscle l'adrénaline joue un rôle importante aussi.
A) Régulation de la glycogène synthase
La glycogène synthase existe sous une forme active déphosphorylé (a) et sous une forme inactive phosphorylé
(b).
Comment passe-t-on de l'un à l'autre ?
→ Sous contrôle du glucagon (foie) et de l'adrénaline (muscle)
Les kinases qui vont permettre cette phosphorylation sont essentiellement, la PKA (voie de signalisation de la
molécule du glucagon) et la GSK3 (glycogène synthèse kinase)
La déphosphorylation ce fait par la PP1 (protéine phosphatase de type 1) sous le contrôle de l'insuline
=> Phénomène relativement semblable dans le foie et le muscle
B) Régulation de la glycogène phosphorylase :
→ Quelque différences entre muscle et foie.
1) Description générale
La glycogène phosphorylase est une protéine dimérique (constitué de sous unités identiques), elle existe sous 2
formes, phosphorylase b non phosphorylé et phosphorylase a qui est phosphorylé.
•L'état dans lequel ce trouve la phosphorylase b peut être sous forme R actif mais aussi sous forme T
inactif. Sous forme b, l'équilibre entre état R et état T est déplacer vers l'état inactif qui peut conduire à
3/6

2016-2017 Métabolisme du glycogène
dire que la phosphorylase b est plutôt dans un état inactif.
•Au contraire quand la phosphorylase est phosphorylé (phosphorylase a) l’équilibre entre R et T est
déplacer vers forme relâcher active ce qui peut conduire a dire que le phosphorylase a est plutôt dans un
état actif.
==> La phosphorylase b plutôt T et la phosphorylase a plutôt R. ++
2) Passage de la forme phosphorylé a la forme non phosphorylé
Intervention d'une phosphorylase kinase (apporte un groupement P) = donneur de groupement phosphate = ATP
cette phosphorylase kinase agit aussi bien sur la forme R et sur la forme T.
L'enzyme qui déphosphoryle = PP1G
3) Régulation allostérique
•Dans le muscle squelettique :
→ AMP et ATP dans la cellule musculaire, les concentrations sont inversées
État R concentrations élevées en AMP fixer sur un site allostérique = sur forme b inactive, AMP stabilise la forme
b dans l'état R relâcher actif, donc quand l'AMP est en concentration élevée la phosphorylase b est active et la
phosphorylase a est toujours active.++++
Quand le muscle à besoin d'ATP (donc en présence de beaucoup d'AMP), la phosphorylase a et b seront dans un
état relâcher actif puis concentration en ATP augmente fortement et quand il y a beaucoup d'ATP, qui remplacer
l'AMP => favorise la conformation T inactive.
=> Quand on est en présence de beaucoup d'ATP : seul la phosphorylase a continuera à être active +++
Régulation allostérique aussi par le G6P : quand il y a beaucoup de G6P, la glycolyse pourra être active, favorise la
forme T inactive de la phosphorylase b, et phosphorylase a toujours active.
•Dans le foie :
–Isoenzyme : la réaction catalyser est la même mais la régulation est différente, homologie de structure
mais régulation différente, notamment la régulation allostérique.
–Régulation allostérique par G6P se fait aussi sur la forme a de la phosphorylase : le G6P inhibe l'action de
phosphorylase a en favorisant l'état T tendu, quand bcp de G6P dans hépatocyte inutile de libéré du
glycogène => phosphorylase a totalement inactive (forme a et b)
–Pas de régulation par l'AMP
4) Régulation par la phosphorylase kinase
→ Gros complexe enzymatique avec plusieurs sous unités : alpha, bêta, gamma et delta
Elle est inactive quand elle est non phosphorylé et partiellement active quand elle est phosphorylé. Elle est
phosphorylé sur la sous unité bêta par des hormones ou une PKA (protéine kinase A).
La sous unité delta porte une activité calmoduline (fixe calcium) peu aussi permettre de partiellement l’activé.
Par le phénomène de contraction de la cellule musculaire en libérant du calcium permet la production d’énergie
dans la cellule.
4/6

2016-2017 Métabolisme du glycogène
→ On peu avoir à la fois phosphorylation et fixation de calcium qui donnera une phosphorylase kinase totalement
active.
Dans ce cas ou elle est totalement active, elle fait passer la glycogène phosphorylase d'un forme non phosphorylé
inactive a un forme phosphorylé active.
Cette glycogène phosphorylase du muscle qui existe sous 2 formes, cette phosphorylation réversible sous contrôle
d'un phosphorylase kinase qui est réguler par une régulation hormonale et par le calcium.
=> Régulation rapide +++
Cela permet donc à la cellule musculaire de s'adapter rapidement.
C) Coordination de la régulation de ces deux voies
Régulation hormonale de la dégradation et de la synthèse de glycogène.
Récapitulation de la voie de dégradation
: on a donc une glycogène phosphorylase sous la dépendance d'une
phosphorylase kinase, cette phosphorylase kinase existe sous forme active ou inactive sous régulation de la PKA
qui elle même est dépendante de l'adrénaline et du glucagon => protéine G dans la cascade on rencontre
l'adénylate cyclase qui transforme l'ATP en AMPc, qui est un effecteur de la PKA.
La voie de synthèse
: glycogène synthase sous contrôle PKA qui es sous contrôle de l'AMPc qui est sous contrôle
de l'adénylate cyclase sous contrôle de l'adrénaline et glucagon
la PKA agit directement sur la synthétase
L'adrénaline favorise la dégradation et inhibe la synthèse mais le phénomène est facilement réversible et
l'insuline et la PP1 inhibe la dégradation et favorise la synthèse.
–déphosphoryle la phosphorylase kinase
–déphosphoryle la glycogène phosphoryle
–et déphosphoryle glycogène synthase et donc l’activé
III) LES MALADIES DE STOCKAGE DU GLYCOGENE OU
GLYCOGENOSES
→ Maladie héréditaire, qui affecte une enzyme impliqué dans le métabolisme du glycogène.
C’est une déficience, mutation ou absence d'enzyme.
Il en existe 8 bien identifiées : en fonction de l'enzyme défectueuse et de l'organe affecter, on aura des présentation
différentes et on aura des anomalies qualitative et quantitative du glycogène.
•Quantitative : plus ou moins de glycogène normal
•Qualitative : anomalie de la structure ou sur les ramification
=> Manifestation clinique sont plus ou moins importante
Exemple : certaine maladie bénigne, empêche la personne de faire un exercice physique intensif mais rien de grave.
Certaine au contraire sont extrêmement grave et à l'origine de mort prématuré.
==> Certaine maladie porte le nom du médecin qui a identifié le mécanisme métabolique touché.
Souvent les organes touchés sont les muscle et le foie.
5/6
En vert : actif
En rouge : inactif
 6
6
1
/
6
100%