EPREUVE DE BIOCHIMIE I 1ère Session Année 2002-2003

Université Cadi Ayyad Année universitaire 2002-2003
Faculté de Médecine et 1ère Année
de Pharmacie de Marrakech
EPREUVE DE BIOCHIMIE I
1ère Session Année 2002-2003
QUESTION 1 (1 point)
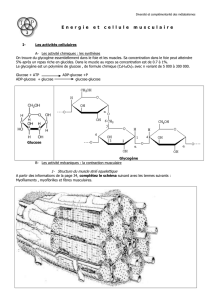
Définir les notions d’enzyme, de coenzyme, de cofacteurs et d’isoenzymes.
QUESTION 2 (1 point)
Dans les conditions de Michaelis Menten, donner graphiquement l’évolution
de v0 en fonction de [S]. Quels sont les paramètres pouvant en être déduits.
QUESTION 3 (4 points)
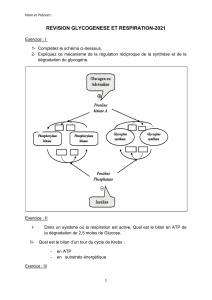
Les voies de biosynthèse et de dégradation du glycogène sont distinctes :
expliquez le principal mécanisme qui en est responsable et quelle en est l’importance
pour le métabolisme hépatique et musculaire.
QUESTION 4 (points)
Quelle réaction, catalysée par l'une des enzymes suivantes, ne subit pas un
contrôle de sa vitesse dans la glycolyse ? Pourquoi ?
a- Pyruvate kinase
b- Phospho-Fructo-Kinase 1
c- Hexokinase
d- Triose-Phosphate Isomérase
Parmi les trois autres quelle est celle dont le rôle régulateur est le plus
important ? Citez ses principaux effecteurs.

Université Cadi Ayyad Année universitaire 2002-2003
Faculté de Médecine et 1ère Année
de Pharmacie de Marrakech
Corrigé de l’épreuve de Biochimie I
1ère Session Année 2002-2003
QUESTION 1
Définir les notions d’enzyme, de coenzyme, de cofacteurs et
d’isoenzymes
Enzyme = catalyseur
Protéine, donc dégradable à la chaleur
Fonctionne seule ou grâce à un coenzyme
Protéine inactive ou apoenzyme + coenzyme enzyme active ou holoenzyme
Nécessite un substrat (notion de site actif)
Coenzyme = élément de nature non protéique indispensable à l’activité de certaines
enzymes (souvent des vitamines)
Cofacteurs = activateurs ou inhibiteurs
Isoenzymes = formes multiples d’une enzyme
Possèdent la même activité
Structure Iaire différente, gènes différents
Exple : LDH 2 types de chaines H et M conduisant à 5 isoenzymes du
fait de la structure de tétramère

QUESTION 2
Dans les conditions de Michaelis Menten, donner graphiquement
l’évolution de v0 en fonction de [S]. Quels sont les paramètres pouvant en être
déduits
Les paramètres sont :
Vmax
Km qui représente la concentration en substrat pour laquelle on a la ½ de la Vmax
1/Km représente l’affinité de l’enzyme pour son substrat
QUESTION 3
Les voies de biosynthèse et de dégradation du glycogène sont
distinctes : expliquez le principal mécanisme qui en est responsable et quelle
en est l’importance pour le métabolisme hépatique et musculaire.
Vmax
v
Vmax
2
S
Km

Réponse : c’est le mécanisme de phosphorylation / déphosphorylation qui
s’exerce sur les deux enzymes clés du métabolisme de synthèse (glycogéne
synthétase) et de dégradation (glycogène phosphorylase) du glucogène
En en activant l’une, il inactive l’autre.
Adényl cyclase
Glucagon Adrénaline
ATP AMPc
Protéine Kinase activée
Glycogène Σ ase active
Glycogène Σ ase
P inactive
Glycogène phosphorylase
Glycogène phosphorylase
P active
Glycogène Glc-1P

Les conséquences au niveau tissulaire sont donc une utilisation
à »l’économie » permettant
une mise en réserve du glycogène hépatique en période d’alimentation
une utilisation du glycogène hépatique en situation de jeûne permettant
une libération de Glc libre (grâce à la Glc6Pase) dans la circulation afin de
fournir les tissus en Glc (cerveau en priorité et GR)
une utilisation du glycogène musculaire lors de contraction musculaire
grâce le la formation d’ATP à l’issue de la glycolyse (pas de Glc 6 Pase, donc
pas de libération de Glc à partir du muscle)
QUESTION 4
Quelle réaction, catalysée par l'une des enzymes suivantes, ne subit pas un
contrôle de sa vitesse dans la glycolyse ? Pourquoi ?
a- Pyruvate kinase
b- Phospho-Fructo-Kinase 1
c- Hexokinase
d- Triose-Phosphate Isomérase
Parmi les trois autres quelle est celle dont le rôle régulateur est le plus
important ? Citez ses principaux effecteurs.
Réponse :
D triose phosphate isomérase car elle catalyse une réaction réversible.
Les autres sont toutes des kinases et donc catalysent des réactions
irréversibles
La plus importante est la phospho fructo kinase PFK 1
 6
6
1
/
6
100%