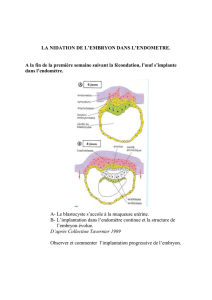
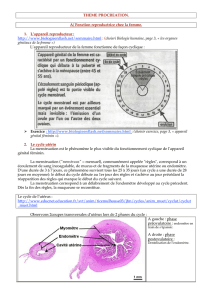
DOSSIER
24
La Lettre du Gynécologue - n° 274 - septembre 2002
e cancer de l’endomètre est la tumeur invasive gyné-
cologique la plus fréquente, atteignant essentielle-
ment les femmes en période péri-ménopausique ou
post-ménopausique. Il s’agit, dans les trois quarts des cas,
d’adénocarcinomes endométrioïdes plus ou moins différenciés.
Ce cancer est favorisé par l’obésité, le diabète, la nulliparité, la
ménopause tardive et les antécédents de troubles menstruels.
Soixante-quinze à 80% des patientes présentant un cancer de
l’endomètre ont une tumeur limitée à l’utérus (stade I ou II)
(1). Un certain nombre de facteurs de risque ont été définis,
permettant d’identifier les patientes qui présentent un risque
élevé de récidive tumorale. Le pronostic des cancers de l’endo-
mètre est lié à l’âge de la patiente, au grade histologique et à la
présence de récepteurs hormonaux. Le pronostic est aussi lié à
la taille de la tumeur et à son extension en profondeur dans le
myomètre ou au-delà. En cas d’extension myométriale > 50%,
des adénopathies sont observées dans 40% des cas, alors que,
dans les formes superficielles, le risque d’atteinte ganglion-
naire est inférieur à 5 %. De même, les formes superficielles
sans atteinte myométriale ont un taux de survie à 5ans proche
de 100%, passant de 95 à 82% dans les atteintes superficielles
inférieures à 50% et de 90 à 73% pour les formes dépassant la
moitié du myomètre selon le grade. L’extension au col
s’accompagne, selon le grade, d’une diminution de la survie
(60%
pour les grades 3). L’extension au-delà de l’utérus, qui
est relativement peu fréquente, représente environ 15 % des
cancers de l’endomètre mais, bien évidemment elle aggrave le
pronostic.
Le cancer de l’endomètre se révèle le plus souvent par l’appari-
tion de métrorragies. Chez la femme en période d’activité géni-
tale, la prise en charge des troubles du cycle menstruel débute
par l’examen clinique. Une fois les causes cervico-vaginales
éliminées, l’examen préconisé est, en règle, l’échographie.
Chez des patientes présentant une cause utérine à leurs saigne-
ments, l’incidence de l’hypertrophie de l’endomètre est de 2 à
10%. Les polypes sont retrouvés dans 30% des cas environ, de
même que les léiomyomes sous-muqueux. La survenue d’un
cancer, rare à cet âge, doit néanmoins être éliminée, en particu-
lier chez la femme de plus de 40 ans, car 10 à 20% des cancers
surviennent dans cette tranche d’âge. Pour les rechercher,
l’échographie doit comprendre au minimum une étude en
modeB par voie sus-pubienne et par voie endovaginale, en uti-
lisant le doppler pour aider à préciser la nature des lésions
observées. En effet, sous l’effet d’une augmentation de l’acti-
vité des facteurs angiogéniques (vascular endothelial growth
factor...), la vascularisation est accrue dans l’hypertrophie
endométriale et le cancer, mais aussi chez les patientes présen-
tant des ménorragies essentielles (2). Dans ce dernier cas, il a
également été montré que les index de pulsatilité enregistrés au
niveau des artères utérines et des artères arquées étaient corré-
lés à l’abondance des saignements chez des patientes de 35 à
49 ans consultant pour des métrorragies sans polype, hypertro-
phie ou fibromyome (3). L’hystérosonographie peut venir en
complément pour affiner le diagnostic. En effet, l’exactitude
diagnostique de cette technique est supérieure à celle de l’écho-
graphie mode B ou de l’hystérographie, et s’approche des capa-
cités diagnostiques de l’hystéroscopie. Pour Indman et al., le
résultat de l’échographie réalisée chez des patientes présentant
un saignement peut être considéré comme normal, anormal ou
incertain et, dans ce cas, la sensibilité de l’échographie est de
96%, mais sa spécificité n’est que de 53% (4). Soares montre
que la sensibilité et la spécificité de l’hystérosonographie sont
de 100 % pour les lésions polypoïdes de la cavité utérine (5).
Ses capacités diagnostiques sont alors voisines de celles de
l’hystéroscopie, méthode de référence. Considérée comme une
des techniques les plus fiables, sa facilité de réalisation avec les
endoscopes souples la place en deuxième position derrière
l’échographie, et même, pour certains, en première place. En
période post-ménopausique, la crainte d’un cancer est plus
importante et nécessite d’éliminer formellement cette hypo-
thèse. La démarche diagnostique est quasi similaire. La réalisa-
tion d’une biopsie à l’aveugle, qui peut fournir le diagnostic
facilement dans 85 à 95 % des cas, expose au risque de faux
négatifs, qui rassure faussement tout en retardant la prise en
charge. Le risque est similaire avec la réalisation d’une cytolo-
gie endométriale, car elle est moins sensible que l’échographie
pour le diagnostic de lésion endométriale maligne (79% versus
98 %) (6). Un endomètre mesurant en échographie plus de
5mm d’épaisseur détecte une pathologie de l’endomètre avec
une sensibilité de 95 % et une spécificité de 92 % (7). Ainsi,
compte tenu d’un faible risque de méconnaître une pathologie
endo-utérine (< 5%), et en particulier un cancer (< 1 %), en cas
d’échographie normale, l’arrêt des investigations peut être pro-
posé, ce qui permet d’éviter des examens inutiles dans 40% des
cas pour certains, le saignement étant alors probablement lié à
Place de l’échographie doppler et de l’IRM pour le diagnostic
et le bilan d’extension des cancers de l’endomètre
●M. Bazot*, S. Bendavid*, Y. Robert**
* Service de radiologie, hôpital Tenon, 4, rue de la Chine, 75020 Paris.
**Service de radiologie, hôpital Jeanne-de-Flandre, av. Eugène-Avinée, 59000 Lille.
L

une atrophie. À l’inverse, toute anomalie doit conduire à la
poursuite des investigations. Au-delà d’une valeur seuil de
5mm, l’échographie permet de découvrir, chez les femmes
ménopausées présentant un saignement anormal, une patholo-
gie (sans préciser la nature de la lésion responsable) avec une
sensibilité de 89 à 97 % et une spécificité de 83 à 74 %. Une
fois la lésion authentifiée, l’hystéroscopie est indiquée afin de
traiter la lésion et/ou de faire un prélèvement pour une étude
histologique ; en cas de doute diagnostique, l’hystéroscopie
souple est une alternative, permettant d’éviter une anesthésie.
Les éléments échographiques pouvant suggérer la présence
d’un cancer sont :
–l’épaisseur de l’endomètre: plus elle est importante, plus le
risque de cancer est élevé (pour une épaisseur d’endomètre
≥15 mm, on peut évoquer le diagnostic de cancer avec une
sensibilité de 88 % et une spécificité de 81 %), mais il existe
des zones de chevauchement entre pathologies tumorales
bénignes et malignes (8). Cette augmentation de l’épaisseur de
l’endomètre est d’autant plus évocatrice de cancer sous-jacent
qu’il existe d’autres anomalies associées;
–un endomètre échogène hétérogène avec des plages hypo-
échogènes, surtout si les contours sont irréguliers (8);
–la présence d’une hypervascularisation endométriale ou sous-
endométriale : elle est observée de façon variable selon les
auteurs, plus fréquente pour certains dans les cancers, plus rare
pour d’autres. La possibilité d’enregistrer des flux artériels
semble plus fréquente dans les cancers, sans qu’une modifica-
tion significative des index de résistance semble exister (9, 10).
De même, l’étude des artères utérines montre une diminution
des index de résistance et de pulsatilité, avec perte de l’encoche
protodiastolique ; ces éléments supplémentaires sont en faveur
du diagnostic de cancer de l’endomètre, mais il existe trop de
chevauchement pour que ce signe puisse à lui seul être un signe
décisionnel, comme cela a pu être suggéré (11);
–en cas de réalisation d’une hystérosonographie, l’irrégularité
des contours endocavitaires et l’absence de distensibilité de la
cavité utérine.
L’évaluation de la régularité des contours externes contribue à
l’appréciation de l’extension tumorale : une tumeur à contours
réguliers est un élément en faveur de son caractère limité à la
cavité utérine, à l’inverse des contours irréguliers ou nodu-
laires et de l’amputation du myomètre, qui sont en faveur
d’une extension en profondeur.
Quels que soient les signes observés en échographie doppler,
le diagnostic de cancer de l’endomètre repose sur les prélève-
ments histologiques effectués par biopsie ou, beaucoup plus
rarement aujourd’hui, après dilatation-curetage. Une fois ce
diagnostic posé, le bilan d’extension pré-opératoire repose sur
la réalisation de diverses méthodes d’imagerie, dont la valeur
apparaît variable selon les auteurs. En pratique quotidienne,
l’IRM apparaît, à ce jour, comme la méthode de référence pour
effectuer ce bilan d’extension des cancers de l’endomètre his-
tologiquement prouvés. Sur les séquences pondérées T2, les
cancers présentent un relatif hypersignal inférieur, le plus sou-
vent à l’endomètre sain, qui occupe une partie plus ou moins
grande de la cavité utérine, celle-ci pouvant apparaître souf-
flée. L’extension en profondeur dans le myomètre (stade IA-B-
C), l’extension au col (stade IIA-B), associées ou non à la pré-
sence d’adénopathies pelviennes ou lombo-aortiques (stade
IIIC), sont les éléments fondamentaux du bilan d’extension
conditionnant le type de prise en charge chirurgicale. La régu-
larité des contours ou la préservation de la zone jonctionnelle
sont en faveur d’une absence d’extension au myomètre (stade
IA). Après injection de gadolinium, la prise de contraste tumo-
rale est en général inférieure à celle du myomètre à la phase
précoce dans la majorité des cas (80 % des cas). Elle tend
cependant à se rehausser sur les séquences les plus tardives ;
elle reste en hyposignal dans 70% des cas, iso-intense au myo-
mètre dans 20% des cas, et parfois en hypersignal dans 10%
des cas (12). La mise en évidence de l’interruption de la prise
de contraste sous-endométriale, une irrégularité des contours
ou une anomalie de signal dans le myomètre permet d’évoquer
l’exten
sion de la tumeur au myomètre et d’évaluer son impor-
tance (13). Au-delà de 50 %, la tumeur passe du stade IB au
stade IC.
L’extension au col est suggérée par la présence de
l’hypersignal tumoral au sein du col utérin (14). Si, pour le
diagnostic positif, l’échographie est le premier examen à
demander, l’IRM est la technique d’imagerie à préconiser dans
le bilan d’extension des cancers de l’endomètre : certains,
comme Del Maschio, considèrent que les résultats entre les
deux méthodes sont voisins (15), mais d’autres, comme
Yamashita, utilisant à la fois le T2 et l’écho de gradient dyna-
mique, obtiennent de meilleurs résultats (16). Kim, qui a com-
paré l’échographie endo-vaginale, le scanner et l’IRM, montre
que l’évaluation est exacte respectivement dans 69%, 61% et
89 % des cas (17). Leur sensibilité et leur spécificité respec-
tives sont de 50 %, 40 % et 90 % et 81 %, 75 % et 88 %. La
méta-analyse récemment réalisée par Kinkel et al. ne montre
paradoxalement aucune différence statistiquement significative
entre ces trois méthodes pour l’appréciation de l’extension
myométriale et cervicale (18).
L’IRM, qui apparaît cependant, en pratique quotidienne, comme
la technique de référence, n’est néanmoins pas à l’abri des diffi-
cultés : les causes d’erreur dans la stadification, en particulier la
distinction entre les stades IA, IB et IB-IC, sont liées à la taille
de la tumeur. C’est le cas, en particulier, des volumineuses
tumeurs polypoïdes, de la présence de myomes utérins, des petits
utérus, de l’absence de zone jonctionnelle visible en pondération
T2, d’un mauvais contraste tissulaire spontané (T2 ou T1 avec
injection de gadolinium) ou d’invasions microscopiques (19).
CONCLUSION
L’échographie doppler joue un rôle déterminant dans la détec-
tion des cancers de l’endomètre chez des patientes présentant
des métrorragies, en particulier en période post-ménopausique.
La découverte d’un épaississement endométrial > 5 mm en
post-ménopause doit conduire à la réalisation d’une hystéro-
scopie ambulatoire couplée à des prélèvements biopsiques
pour éliminer ou confirmer la présence d’un cancer endomé-
trial. Une fois le diagnostic posé, l’IRM apparaît comme la
technique la plus performante pour déterminer l’existence
d’une extension myométriale, cervicale, ainsi que la présence
ou l’absence d’adénopathies. ■
25
La Lettre du Gynécologue - n° 274 - septembre 2002

DOSSIER
26
La Lettre du Gynécologue - n° 274 - septembre 2002
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Kurman RJ, Zaino RJ, Norris HJ. Endometrial carcinoma. In: J KR, editor.
Blaustein’s pathology of the female genital tract. 4 ed. New York: Springer-
Verlag, 1994: 439-86.
2. Abulafia O, Triest WE, Sherer DM et al. Angiogenesis in endometrial hyper-
plasia and stage I endometrial carcinoma. Obstet Gynecol 1995; 86: 479-85.
3. Hurskainen R, Teperi J, Paavonen J et al. Menorrhagia and uterine artery
blood flow. Hum Reprod 1999; 14: 186-9.
4. Indman PD. Abnormal uterine bleeding. Accuracy of vaginal probe ultra-
sound in predicting abnormal hysteroscopic findings. J Reprod Med 1995; 40:
545-8.
5. Soares SR, Barbosa dos Reis MM, Camargos AF. Diagnostic accuracy of
sonohysterography, transvaginal sonography, and hysterosalpingography in
patients with uterine cavity diseases. Fertil Steril 2000; 73: 406-11.
6. Tsuda H, Kawabata M, YamamotoK et al. Prospective study to compare
endometrial cytology and tranvaginal ultrasonography for identification of
malignancies. Gynecol Oncol 1997; 65: 383-6.
7. Smith-Bindman R, Kerlikowske K, Feldstein VA et al. Endovaginal ultra-
sound to exclude endometrial cancer and other endometrial abnormalities.
JAMA 1998; 280: 1510-7.
8. Hulka CA, Hall DA, McCarthy K et al. Endometrial polyps, hyperplasia, and
carcinoma in postmenopausal women : differentiation with endovaginal sono-
graphy. Radiology 1994; 191: 755-8.
9. Sladkevicius P, Valentin L, Marsal K. Endometrial thickness and doppler
velocimetry of the uterine arteries as discriminators of endometrial status in
women with postmenopausal bleeding : a comparative study. Am J Obstet
Gynecol 1994; 171: 722-8.
10. Sheth S, Hamper UM, Kurman RJ. Thickened endometrium in the postme-
nopausal woman: sonographic-pathologic correlation. Radiology 1993; 187:
135-9.
11. Bourne TH, Campbell S, Whitehead MI et al. Detection of endometrial can-
cer in postmenopausal women by transvaginal ultrasonography and colour flow
imaging. Br J Med 1990; 301: 369.
12. Seki H, Kimura M, Sakai K. Myometrial invasion of endometrial
carcinoma: assessment with dynamic MR and contrast-enhanced T1-weighted
images. Clin Radiol 1997; 52: 18-23.
13. Yamashita Y, Harada M, Sawada T et al. Normal uterus and FIGO stage I
endometrial carcinoma : dynamic gadolinium-enhanced MR imaging.
Radiology 1993; 186: 495-501.
14. Hricak H, Rubinstein LV, Gherman GM et al. MR imaging evaluation of
endometrial carcinoma: results of an NCI cooperative study. Radiology 1991;
179: 829-32.
15. DelMaschio A, Vanzulli A, Sironi S et al. Estimating the depth of myome-
trial involvement by endometrial carcinoma : efficacy of transvaginal sonogra-
phy vs MR imaging. AJR Am J Roentgenol 1993; 160: 533-8.
16. Yamashita Y, Mizutani H, Torashima M et al. Assessment of myometrial
invasion by endometrial carcinoma: transvaginal sonography vs contrast-
enhanced MR imaging. Am J Roentgenol 1993; 161: 595-9.
17. Kim SH, Kim HD, Song YS et al. Detection of deep myometrial invasion in
endometrial carcinoma : comparison of transvaginal ultrasound, CT, and MRI.
J Comput Assist Tomogr 1995; 19: 766-72.
18. Kinkel K, Kaji Y, Yu KK et al. Radiologic staging in patients with endome-
trial cancer: a meta-analysis. Radiology 1999; 212: 711-8.
19. Scoutt LM, McCarthy SM, Flynn SD et al. Clinical stage I endometrial car-
cinoma : pitfalls in preoperative assessment with MR imaging. Work in pro-
gress. Radiology 1995; 194: 567-72.
Les articles publiés dans “La Lettre du Gynécologue” le sont sous la seule responsabilité de leurs auteurs.
Tous droits de traduction, d’adaptation et de reproduction par tous procédés réservés pour tous pays.
© janvier 1984 ÉDIMARK S.A.
Imprimé en France - DIFFERDANGE - 95100 Sannois - Dépôt légal à parution.
1
/
3
100%