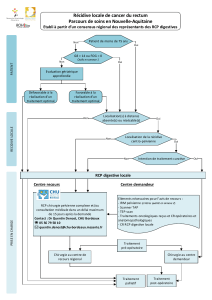
Métastases d’adénocarcinomes sigmoïdiens dans des fistules anales préexistantes

* Service de proctologie médico-interventionnelle, groupe hospitalier
Diaconesses – Croix-Saint-Simon, Paris.
Métastases d’adénocarcinomes sigmoïdiens
dans des fistules anales préexistantes
●P. Bauer*
L
a découverte d’un adénocarcinome au sein d’une fistule
anale à point de départ crypto-glandulaire implique, entre
autres, de rechercher un adénocarcinome du sigmoïde
sus-jacent, d’autant plus que son étude en immunohistochimie, en
particulier des cytokératines (CK), n’apparaît pas compatible avec un
adénocarcinome primitif des glandes anales d’Hermann et Desfosses.
En fait, la présence de tissu adénocarcinomateux dans une fistule
anale peut correspondre à :
1. Un cancer primitif des glandes anales d’Hermann et Desfosses
se manifestant sous la forme d’une fistule anale ; il peut s’agir d’un
d’adénocarcinome mucineux bien différencié ; dénommé colloïde,
tout particulièrement dans la littérature de langue française, lorsque
la sécrétion de mucus est cliniquement abondante. En immunohisto-
chimie, les adénocarcinomes issus des glandes anales sont plutôt
d’immunophénotype CK7+ / CK20-, mais, plutôt d’immuno-
phénotype CK7+ / CK20+ en cas d’adénocarcinome mucineux.
2. La dégénérescence de l’épithélium d’une fistule anale préexis-
tante chronique ancienne (issue elle-même d’une infection d’une
glande anale d’Hermann et Desfosses).
3. Une rare métastase anale d’un adénocarcinome primitif situé très
à distance (côlon, sein, rein, pancréas, poumon) pouvant secondai-
rement s’abcéder et se fistuliser (1, 2).
4. Un adénocarcinome sigmoïdien métastasé dans une fistule
anale préexistante ; pour mémoire, les adénocarcinomes de type
colorectal (lieberkühnien) possèdent plutôt un immunophénotype
CK7- / CK20+ (1, 3).
Il est rapporté six observations d’adénocarcinome du sigmoïde méta-
stasé dans une fistule anale préexistante (1,2,4-6). Un seul patient
a bénéficié d’une étude des cytokératines ; les autres n’ont même
pas fait l’objet d’une étude immunohistochimique des mucines
(évaluation des O-acetylated sialic acids) qui permettait, avant l’intro-
duction de l’étude des cytokératines, un minimum de discrimina-
tion entre les lésions issues de l’épithélium rectocolique glandulaire,
de type lieberkühnien, et les lésions issues de la muqueuse des
glandes anales.
Dans les métastases anales d’adénocarcinomes du sigmoïde, au
sein ou non d’une suppuration (1, 2, 4-7),il est possible d’évoquer :
une extension intramurale rétrograde de proche en proche, une inva-
sion lymphatique rétrograde, une dissémination par voie veineuse
rétrograde ; mécanismes à ne retenir, en principe, que si les deux
tumeurs ne sont pas “éloignées” l’une de l’autre (1, 8).
Ainsi, une greffe de cellules tumorales viables exfoliées dans la lumière
colique est le mécanisme le plus souvent retenu :
1. La présence et la viabilité de ces cellules exfoliées sont claire-
ment établies et mises en cause dans des récidives observées pré-
cocement sur la zone d’anastomose après résection d’un cancer
colique.
2. L’implantation au niveau du canal anal se produirait à la faveur
d’une lésion muqueuse préexistante : plaies ou cicatrices d’hémor-
roïdectomie (1),zones de ligature élastique ou d’injection scléro-
sante du tissu hémorroïdaire (9). En leur absence, il est supposé que
des manœuvres diagnostiques (coloscopie) ou thérapeutiques (pince
pour agrafage mécanique) sont susceptibles d’induire des micro-
l
ésions de la muqueuse anale (1,10). Parfois, aucun de ces facteurs,
considérés comme favorisants, n’est retrouvé.
Ainsi, la présence d’un adénocarcinome anal, avec ou sans suppu-
ration associée, implique, d’une part, une étude immunohistochimique
et, d’autre part, au minimum, une rectosigmoïdoscopie ; en réalité,
une coloscopie est indispensable à la recherche d’un cancer syn-
chrone, bien plus fréquent que ce type de métastases. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Wisniewski B, Vuong PN, Balaton A et al. Une suppuration anale chez un
cancéreux. Hépato-Gastro 2004;11:309-11.
2. Killingback M,Wilson E, Hughes ES. Anal metastases from carcinoma of the
rectum and colon. Aust NZ J Surg 1964;34:178-87.
3. Li SC, Waters BL, Simmons-Arnold L et al. Cytokeratin 7 and 20 expressions
in rectal adenomas, rectal adenocarcinomas, anal glands, and junctional rectal
mucosa. Mod Pathol 2001;14:90A.
4. Guiss RL. The implantation of cancer cells within a fistula in ano. Surgery
1954;36:136-9.
5. Rollinson PD, Dundas SA. Adenocarcinoma of sigmoid colon seeding into
pre-existing fistula in ano. Br J Surg 1984;74:664-5.
6. Zbar AP, Shenoy RK. Synchronous carcinoma of the sigmoid colon and a
perianal fistula. Dis Colon Rectum 2004;47:544-5.
7. Scott NA, Taylor BA, Wolff BG et al. Perianal metastasis from a sigmoid car-
cinoma–Objective evidence of a clonal origin. Report of a case. Dis Colon
Rectum 1988;31:68-70.
8. Smiley D, Golberg RI, Phillips RS et al. Anal metastasis from colorectal car-
cinoma. Am J Gastroenterol 1988;83:460-2.
9. Abbasakoor F, Srivastava V, Swarnkar K et al. Implantation anal metastases
after outpatient treatment of haemorrhoids. Ann R Coll Surg Engl 2004;86:38-9.
10. Delluc C, Gornet JM, Cattan P et al. Métastase anocutanée précoce d’un
cancer du rectum après chirurgie d’exérèse avec suture mécanique transanale.
Gastroenterol Clin Biol 2004;28:1298-9.
La lettre de l’hépato-gastroentérologue - n° 3 - vol. VIII - mai-juin 2005
120
MISE AU POINT BRÈVE
1
/
1
100%