Document

Chapitres 17-18
Activation et protection de fonctions organiques
1-Les objectifs du chapitre
•Activation de la nucléophilie des alcools par passage aux alcoolates correspondants.
•Les conditons d'activation électrophile des alcools pour rompre la liaison C-O.
•Activation des alcools par passage par un ester sulfonique.
•Activation électrophile des carbonyles en milieu acide.
•La mutarotation du glucose
•La protection du groupe carbonyle sous forme d'acétale et déprotection.
•utilisation des diols pour protéger les carbonyles sous forme d'acétales cycliques et
déprotection.
Ce que je dois connaître
•Comparer la nucléophilie d'alcools de différentes classes.
•Choisir une base pour déprotoner un alcool et un phénol.
•Ecrire le mécanisme de la synthèse de Williamson.
•Ecrire le macanisme de la déshydratation d'un alcool en alcène.
•Ecrire le mécanisme de l'action d'un halogénure d'hydrogène HX sur un alcool.
•Ecrire le mécanisme de l'acétalisation par catalyse acide.
•Ecrire le mécanisme de l'hémiacétalisation du glucose.
•Ecrire et reconnaitre le mécanisme de protection et déprotection d'un groupe
carbonyle, d'un groupe hydroxyle, d'un diol.
Ce que je dois savoir faire

2-Je maîtrise l’essentiel du chapitre
a-Activation nucléophile des alcools et phénols
•A cause des doublets non liant sur l'oxygène, les alcools et phénols sont des nucléophiles moyens.
•La nucléophilie diminue avec la classe des alcools à cause de l'encombrement stérique.
•Les alcoolates (R-O-) sont plus nucléophiles que les alcools (R-OH) conjugués correspondants.
•On augmente la nucléophilie d'un alcool (R-OH) en le transformant en alcoolate conjugué(R-O-) en
présence d'une base appropriée. il en est de même pour les phénols (Ph-OH) en ion phénolate (Ph-O-
).
•On active la nucléophilie d'un alcool (ou phénol) en le transformant en sa base conjuguée alcoolate.
Nucléophilie des alcools et
phénols
•Le pKa du couple alcool/ ion alcoolate : 15-16 donc les alcools sont des acides faibles. HO-n'est pas une
base suffisament forte (pKA du couple H2O/HO-:14) pour transformer l'alcool R-OH en alcoolate R-O-.
•Il faut choisir une base dont le pKa du couple acide/ base correspondant est supérieur (à 15-16) au pKa du
couple alccol/alcoolate.
•On utilise pour cette transformation des bases fortes telles que les ions amidures NH2-, RNH-, R2N-dont le
pKa est de l'ordre de 35. On utilise aussi une réaction redox en traitant l'alcool par du sodium solide (Na).
•Pour les phénols, le pKa du couple est de l'ordre de 10. Dans ce cas, l'ion HO-est une base suffisament
forte pour faire la transformation du phénol (Ph-OH) en ion phénolate Ph-O-.
Obtention d'alcoolates et
phénolates
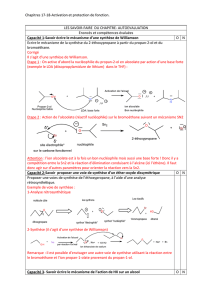
•La synthèse de williamson consiste à préparer un éther-oxyde (R-O-R') par action d'un ion
alcoolate (ou phénolate Ph-O-) sur un halogénoalcane (R'-X) selon:
•R-O-+ R'X → R-O-R' + X-
•C'est une réaction de substitution nucléophile en général de type SN2 si R'X est primaire ou peu
encombré.
•Si R=R' on obtient un éther-oxyde symétrique ou dissymétrique dans le cas contraire.
Application de la nucléophilie
des alcools: la synthèse de
Williamson des éthers-oxydes.

b-Activation électrophile des alcools
δ+
δ-
•La liaison C-O est polarisée car loxygène est plus électronégatif que le carbone. Dans les
alcools, le carbone fonctionnel porte donc une charge partielle positive et constitue un site
électrophile.
•L'attaque d'un réactif nucléophile sur ce site doit entrainer le départ du groupe -OH
(mauvais nucléofuge) avec rupture de la laison C-O
Les alcools possèdent un site
électrophile
•Le groupe HO- est un mauvais groupe nucléofuge (groupe partant) car la rupture de la
liaison C-O est très difficile. Il est nécessaire de réaliser une activation électrophile de
l'alcool, pour transformer le groupe -OH en un bon groupe partant.
Nécessité d'une activation du
groupe -OH des alcools pour
augmenter leur électrophilie.
•L'activation du groupe -OH peut se faire:
•-Par protonation, en transformant le groupe -OH en groupe -OH2+(H2O est un bon groupe
nucléofuge). On utilise pour cela un acide fort comme l'acide sulfurique H2SO4.
•-Par formation d'un ester sulfonique. Pour préparer le tosylate (R-OTs) on fait réagir l'alcool
avec le chlorure de paratoluènesulfonyle (chlorure de tosyle) dans la pyridine. Pour préparer
le mésylate (R-OMs), on fait réagir l'alcool avec le chlorure de méthanesulfonyle (chlorure
de mésyle) dans la pyridine.
Activation du groupement
OH

•Le pouvoir nucléofuge d'un groupement (X, OH, OTs, OMs, OH2+ ) peut être relié à la
polarisabilité de la liaison qui se rompt au cours de la réaction.Il est aussi relié à la
basicité du groupe partant. Un groupe est d'autant plus nucléfuge (bon groupe partant)
que le groupe partant est une base faible (plus stabilisée).
•Les sulfonates (tosylate et méshylate) sont d'excellents groupes partants, H2O est
meilleur groupe partant que OH-. Dans les halogénures, le caractère nucléofuge croît de
F-à I- . I- et Br- sont de bon groupes partants.
Caractère nucléofuge de
différents groupements
•Lorsqu'un alcool possède un atome H en position βde l'atome de carbone fonctionnel,
il peut subir une réaction de déshydratation (libération d'une molécule d'eau) pour
conduire à un alcène, en milieu acide (H2SO4).
•Bilan réactionnel: (voir ci-dessous)
•Conditions copératoires: la déshydratation d'un alcool nécessite une catalyse acide
(H2SO4) et une température élevée, environ 180°C). La réaction est sous contrôle
thermodynamique.
•Sélectivité de la réaction: La réaction de déshydratation d'un alcool conduit
majoritairement à l'alcène le plus stable, (en générale l'alcène le plus substitué par des
groupes alkyles- ou la déshydratation conduisant à un alcène conjugué):on dit que la
déshydratation suit la règle de Zaïtsev.
•Mécanisme: Après activation d'un alcool tertiaire par l'acide sulfurique, l'alcool activé
subit une déshydratation suivant un mécanisme limite E1 (avec passage par un
carbocation) pour conduire à un alcène.
•Dans le cas des alcools primaires et secondaires,après activation, la déshydratation
peut se faire suivant un mécanisme limite E1 ou E2.
•Remarque: pour les alcools primaires et secondaires cette réaction de déshydratation
intramoléculaire est en compétition avec une réaction de substitution d'une molécule
d'alcool sur une molécule d'alcool activé, c'est à dire une réaction de déshydratation
intermoléculaire conduisant à un éther oxyde symétrique. Cette réaction parasite
n'intervient pas dans le cas des alcools tertiaires car trop encombrés.
•2 R-OH (H2SO4+ chauffage) → R-O-R + H2O
Utilisation de l'activation
électrophile des alcools:
Déshydratation acido-
catalysée intramoléculaire
d'un alcool.

Bilan de la réaction de déshydratation acido-catalysée d’un alcool
Δ
•L'activation électrophile de l'alcool peut être réalisée par formation d'un ester
méthanesulfonique (R-SO3-CH3). L'action d'une base forte encombrée sur l'ester
méthanesulfonique entraîne une élimination avec formation d'un alcène et départ du
groupe nucléofuge CH3SO3-.
Utilisation de l'activation
électrophile d'un alcool:
formation d'alcène par
élimination basique sur un
mésylate.
•Par réaction entre un alcool et un halogénure d'hydrogène HX
•On effectue l'action de HBr ou HI pour convertir un alcool en halogénoalcane. On
utilise HCl pour la transformation d'un alcool secondaire ou tertiaire en chloroalcane.
•Bilan réactionnel: ROH + HX → RX + H2O
•Mécanisme: il ya activation électrophile de l'alcool par protonation (formation de
ROH2+), suivie d'une substitution nucléophile de l'ion halogénure sur l'atome de
carbone électrophile de l'alcool activé, selon un mécanisme SN1 ou SN2.
•Par substitution sur un tosylate ou un mésylate
•L'alcool est d'abord activé en ester sulfonique. Puis on effectue l'action d'un ion
halogénure sur l'ester sulfonique conduisant à une substitution avec obtention d'un
dérivé halogéné et départ du groupe nucléofuge RSO3-.
Utilisation de l'activation
électrophile d'un alcool:
Conversion d'un alcool en
halogénoalcane.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%