N o u v e l l e s ... Vers une nouvelle perception de la prolactine en physiopathologie humaine .

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 6, novembre-décembre 2001
269
L
a prolactine est une hormone paradoxale.
Alors que la recherche fondamentale lui
attribue un spectre d’actions biologiques
extrêmement vaste, cette multiplicité fonc-
tionnelle ne trouve que peu d’écho dans le
contexte physiopathologique. En effet, si
Nouvelles approches
Vers une nouvelle perception de la prolactine
en physiopathologie humaine .
V. Goffin*, Ph. Touraine**, N. Binart*, P.A. Kelly*
✎La prolactine est aujourd’hui considérée comme une
cytokine à part entière. Son récepteur appartient à la
superfamille des récepteurs de cytokines hématopoïétiques
(comprenant l’érythropoïétine, plusieurs interleukines, la
leptine, etc.). Chez l’homme, trois hormones (prolactine,
hormone de croissance, lactogène placentaire) peuvent se
lier et activer le récepteur de la prolactine. Notre compré-
hension du rôle respectif de chacun de ces ligands dans les
fonctions relayées par le “récepteur de la prolactine” est
encore assez limitée.
✎La prolactine exerce des activités biologiques nom-
breuses et variées ; ses cibles principales sont la glande
mammaire et le système reproducteur. Cependant, les
modèles de souris knockout (pour la prolactine ou son
récepteur) ou transgéniques (pour la prolactine) récemment
développés ont permis d’identifier (ou de renforcer l’exis-
tence) de nouvelles cibles de la prolactine (prostate, os,
tissu adipeux).
✎La source principale de prolactine est l’hypophyse, mais
de nombreux autres tissus périphériques la sécrètent éga-
lement (glande mammaire, prostate, placenta, lympho-
cytes, etc.). Les facteurs régulant l’expression extra-hypo-
physaire de prolactine sont inconnus, mais apparemment
différents de ceux impliqués dans l’hypophyse ; plus parti-
culièrement, les agonistes de la dopamine, principal régu-
lateur négatif de la synthèse hypophysaire de prolactine,
sont sans effet sur la synthèse extra-hypophysaire de l’hor-
mone. Cette prolactine extra-hypophysaire semble agir
selon un mode d’action autocrine-paracrine, voie totale-
ment ignorée dans l’approche physiopathologique (théra-
peutique) actuelle de l’hormone.
✎La prolactine stimule la prolifération tumorale de plu-
sieurs de ses tissus cibles, dont la glande mammaire (can-
cer du sein) et la prostate. Il est suspecté que cet effet
implique un mécanisme autocrine-paracrine de la prolacti-
ne produite localement, sur lequel les classiques analogues
dopaminergiques sont sans effet.
✎Des antagonistes de la prolactine ont été développés
par mutagenèse dirigée de l’hormone ; il s’agit de mutants
de prolactine qui sont capables de lier le récepteur, mais
ne peuvent plus l’activer ; ils peuvent donc inhiber les effets
de la prolactine naturelle par un mécanisme de compétition
pour la liaison au récepteur. L’inhibition de l’effet prolifé-
ratif que la prolactine exerce sur des cellules tumorales
mammaires humaines a pu être démontrée in vitro lors de
l’addition d’antagonistes de la prolactine.
✎En résumé, la multiplicité des tissus cibles de la prolac-
tine in vivo, l’importance mieux définie du mécanisme
d’action autocrine-paracrine de la prolactine d’origine
extra-hypophysaire et, enfin, la disponibilité d’antago-
nistes de l’hormone figurent parmi les éléments de
réflexion essentiels suggérant de revisiter la perception
physiopathologique actuelle de la prolactine.
*INSERM unité 344, endocrinologie moléculaire, faculté de médecine Necker.
** Département d’endocrinologie et médecine de la reproduction,
hôpital Necker-Enfants malades, 156, rue de Vaugirard, 75730 Paris Cedex 15.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 6, novembre-décembre 2001
270
Nouvelles approches
l’on exclut l’hyperprolactinémie, qui est à
ce jour la seule pathologie corrélée de
manière directe à la prolactine et reconnue
comme telle, cette hormone est générale-
ment ignorée dans l’approche thérapeutique
de pathologies liées au contexte endocri-
nien. Les raisons en sont diverses. D’une
part, si l’efficacité des analogues dopami-
nergiques (inhibiteurs de la synthèse hypo-
physaire de PRL) est démontrée dans les cas
d’hyper-prolactinémie, il n’en a pas été de
même pour d’autres pathologies dans les-
quelles l’implication de la prolactine fut
pressentie, puis rapidement remise en ques-
tion au vu du manque de résultats obtenus
par ce type de traitement ; l’exemple
typique est le cancer du sein. D’autre part,
dans les pathologies typiquement liées au
contexte hormonal, force est de reconnaître
le rôle prépondérant joué par les hormones
stéroïdes et gonadotropes qui, au contraire
de la prolactine, constituent les cibles théra-
peutiques privilégiées. Par ailleurs, aucune
maladie génétique liée à une mutation de la
prolactine ou son récepteur n’ayant pu être
décelée à ce jour, ce qui fait désormais figu-
re d’exception, il n’existe actuellement
aucun modèle pathologique humain permet-
tant d’associer clairement un (ensemble de)
phénotype(s) reflétant un défaut fonctionnel
lié à cette hormone.
Découverte il y a plus de 70 ans, la prolactine
a fait l’objet d’innombrables études suivant
des approches d’endocrinologie classique.
Cependant, l’ensemble des travaux réalisés au
cours de ces quelques dernières années a permis
d’accroître considérablement nos connais-
sances quant à son fonctionnement, ce qui nous
amène aujourd’hui à regarder cette hormone
sous un angle quelque peu différent. C’est le
message essentiel que nous développerons
dans cette rubrique. Dans un premier temps, nous
décrirons les acteurs en présence, à savoir
principalement la prolactine et son récepteur ;
puis, dans un second temps, nous survolerons
quelques unes des avancées principales de
la décennie écoulée. Ces diverses notions
nous amèneront à rediscuter dans la dernière
partie de cette revue des applications cliniques
potentielles dans lesquelles la prolactine
pourrait éventuellement jouer un rôle nouveau.
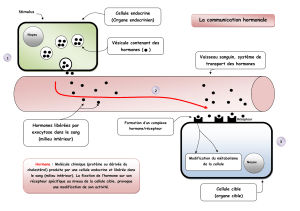
La prolactine
La prolactine (PRL) est l’hormone de la lac-
tation par excellence, fonction d’ailleurs à
l’origine de son appellation : “pro-lactine”.
Comme nous le verrons plus loin, cepen-
dant, son activité biologique est loin de se
limiter à la stimulation de la glande mam-
maire. C’est une hormone polypeptidique,
synthétisée majoritairement par l’hypophyse
chez tous les vertébrés. Chez l’homme, le
gène de la PRL (unique) est localisé sur le
chromosome 6 et code pour une protéine
mature de 199 acides aminés (pour une
masse moléculaire de 23 000 daltons) ; sa
structure tridimensionnelle, constituée de
4hélices αanti-parallèles, est similaire à
celle de l’hormone de croissance ou encore
de l’érythropoïétine (1, 2) (figure 1, A).
Bien que l’on trouve de nombreux variants
de PRL résultant, par exemple, de l’addition
de groupements sucrés (glycosylation) ou
phosphatés (phosphorylation), ou encore de
l’agrégation de plusieurs molécules entre
elles (multimères) ou avec d’autres molé-
cules (comme des immuno-globulines), la
PRL monomérique ne contenant pas de
modification post-traductionnelle est biolo-
giquement active.
La source principale de PRL est l’hypophy-
se antérieure, et, au sein de celle-ci, les cel-
lules lactotropes. L’expression du gène de la
PRL est sous le contrôle de multiples stimu-
li, relayés principalement par des facteurs
hypothalamiques. D’une manière schéma-
tique, on peut considérer que le facteur
régulateur principal est la dopamine (sécré-
tée par certains neurones hypothalamiques
au niveau de l’éminence médiane de l’hypo-
physe). Ce stimulus dopaminergique est
inhibiteur, c’est-à-dire qu’il freine la synthè-
se de PRL par les cellules lactotropes.
Celle-ci est également régulée par de très
nombreux autres facteurs, comme la TRH
ou encore les estrogènes. Lors de l’allaite-
Figure 1. Structure de la prolactine humaine et de son récepteur.
A. La hPRL (199 acides aminés) adopte la structure tridimensionnelle caractéristique des cytokines
hématopoïétiques, constituée de 4 hélices αanti-parallèles (notées h1 à h4). Les deux sites de liaison de la
hPRL à son récepteur (voir figure 3) sont localisés sur l’hormone (sites 1 et 2), et les chaînes latérales des
acides aminés impliqués dans l’interaction du site 1 avec le récepteur sont représentées en violet.
B. Représentation schématique des différentes isoformes du PRLR humain. On distingue la forme longue,
majoritaire, une forme intermédiaire, récemment identifiée et de fonction encore inconnue, et la protéine de
liaison soluble ; ces trois isoformes ont été clonées à partir de cellules tumorales mammaires humaines (T-
47D). Symboles : C-C : ponts disulfures ; motifs colorés (jaune et vert) : régions hautement conservées
parmi les récepteurs de cytokines (pour détails, voir 4).

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 6, novembre-décembre 2001
271
Nouvelles approches
ment du nouveau-né, un stimulus activateur
provoqué par la succion (l’ocytocine) aug-
mente en quelques minutes, et de manière
très transitoire, la sécrétion de PRL. La
régulation du gène de la PRL est cependant
beaucoup plus complexe que ne pourrait le
laisser penser l’évocation de ces quelques
exemples ; sa description a fait l’objet d’un
revue récente (3). Une fois déversée dans le
système porte hypophysaire, la PRL sérique
est véhiculée vers l’ensemble de ses tissus
cibles ; sa concentration circulante normale
oscille autour de 10 ng/ml chez la femme
(homme ?), mais peut atteindre plusieurs
centaines de ng/ml en fin de gestation.
Nous terminerons ce paragraphe en men-
tionnant que la PRL fait partie d’une famille
hormonale comprenant l’hormone de crois-
sance (GH), une autre hormone hypophysaire,
et l’hormone lactogène placentaire (PL),
produit uniquement par le placenta. Ces
trois hormones sont issues d’un gène ances-
tral commun et possèdent à ce titre de très
nombreuses similitudes structurales (gène et
protéine) et fonctionnelles (moléculaires et
biologiques) (1). Chez l’homme, les trois
hormones sont capables de se lier au récep-
teur dit “de la PRL”, ce qui complique
considérablement notre compréhension
puisque la contribution individuelle des
deux (en contexte normal) ou trois (en ges-
tation) ligands aux effets relayés par le
récepteur de la PRL est très mal évaluée.
Le récepteur de la prolactine
Le récepteur de la PRL (PRLR) a été cloné
par notre équipe en 1988, à partir d’une
banque d’ADNc de foie de rat. C’est un
récepteur de type I, c’est-à-dire qu’il com-
porte un domaine extracellulaire interagis-
sant avec l’hormone, un seul domaine trans-
membranaire, et un domaine cytoplasmique
impliqué dans la transmission du signal hor-
monal dans la cellule. Bien que le gène du
PRLR soit unique, il existe plusieurs iso-
formes protéiques du récepteur, qui ne se
différencient que par la longueur de leur
domaine cytoplasmique (oscillant de
≈600 aa à ≈300 aa) ; ainsi, selon les
espèces, on distinguera les formes dites
longues, intermédiaires et courtes (figure
1,B). Ces différentes isoformes possèdent
certaines spécificités fonctionnelles puisque
la région impliquée dans la transmission du
signal – la partie cytoplasmique – est diver-
gente. Bien que l’on considère générale-
ment que les formes longues soient capables
d’exercer l’ensemble des fonctions attri-
buées au PRLR, l’activité des isoformes
intermédiaire et courte reste encore assez
mal comprise, tout spécialement in vivo.
Ces différentes isoformes du PRLR intè-
grent diverses modifications post-traduc-
tionnelles telles que la glycosylation
(domaine extracellulaire) ou, lorsque le
récepteur est activé, la phosphorylation sur
tyrosine (domaine intracellulaire). Enfin,
notons qu’il existe également une forme
soluble du récepteur (ou protéine de liai-
son), correspondant au seul domaine extra-
cellulaire du récepteur membranaire ; selon
les espèces, elle sera générée par épissage
alternatif du transcrit primaire ou par pro-
téolyse limitée du récepteur membranaire,
voire par les deux mécanismes. Chez l’hom-
me, la forme longue (598 aa, 90 kDa) repré-
sente l’isoforme majoritaire. Plus récem-
ment, des transcrits codant pour une forme
soluble et pour une isoforme membranaire
de longueur intermédiaire ont été clonés à
partir de cellules tumorales mammaires (4).
Sur la base de quelques similitudes de
séquence protéique, le PRLR fut, en compa-
gnie des récepteurs de l’érythropoïétine, de
l’hormone de croissance (GH), de la chaîne
αdu récepteur de l’interleukine (IL)-6 et de
la chaîne βdu récepteur de l’IL-2, un des
membres pionniers d’une famille de récep-
teurs découverte en 1989 : la “superfamille
des récepteurs de cytokines hématopoïé-
tiques”. À l’heure actuelle, on dénombre
une trentaine de récepteurs de cytokines
répartis en deux classes, parmi lesquels on
peut citer, outre ceux mentionnés ci-dessus,
les récepteurs de la leptine, de la majorité
des interleukines (IL-1 à IL-15, sauf IL-1 et
IL-8), et des interférons (5). Ce regroupe-
ment du PRLR avec ces récepteurs de cyto-
kines n’est pas anodin puisque, d’une part,
il permet de considérer l’hormone PRL
comme une “cytokine” à part entière – et
l’on connaît l’importance de ces protéines
en physiopathologie – et, d’autre part, la
compréhension du fonctionnement molécu-
laire du couple PRL/PRLR a largement
bénéficié des observations rapportées pour
d’autres cytokines et leurs récepteurs,
notamment en ce qui concerne la transmis-
sion du signal dans l’espace intracellulaire.
Le PRLR est, comme l’ensemble de la
superfamille, dépourvu de toute activité
enzymatique intrinsèque : la transmission
du signal fait appel à diverses kinases asso-
ciées. Jusqu’au début des années 90, les
mécanismes intracellulaires conduisant à
l’expression de “l’activité PRL” étaient très
mal compris, l’activation des voies de signa-
lisation classiques (protéine kinase C, phos-
pholipase, AMP cyclique, etc.) ne semblant
pas être suffisantes pour refléter l’ensemble
des activités relayées par le PRLR. Les pro-
grès considérables effectués dans le décoda-
ge des étapes de la transmission du signal
par les récepteurs d’autres cytokines,
comme, par exemple, les interférons ou
l’érythropoïétine, ont permis d’identifier la
tyrosine kinase JAK2 comme un élément
essentiel de la signalisation intracellulaire
par le PRLR (4). À l’heure actuelle, on
considère que l’activation de JAK2 est
requise pour l’expression de la majorité,
sinon de toutes les activités biologiques
transmises par ce récepteur. Bien que les
substrats de l’enzyme JAK2 soient sans
doute très nombreux, les mieux connus
sont, outre la kinase elle-même (qui s’active
par auto-phosphorylation), le PRLR et les
protéines de la famille des Stats (figure 2).
Les tyrosines du récepteur, phosphorylées
par JAK2 lors de l’activation par le ligand,
jouent un rôle fondamental dans les cas-
cades de transmission du signal intracellu-
laire car ces acides aminés modifiés sont
reconnus par des motifs structuraux appelés
domaines SH2 (pour Src Homology domain
2) portés par de nombreuses protéines de
signalisation ; ces phosphotyrosines peuvent
donc être considérées comme des “interrup-
teurs” permettant à deux protéines d’inter-
agir. À ce titre, elles constituent des points
d’ancrage pour des protéines de la famille

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 6, novembre-décembre 2001
272
Nouvelles approches
des Stats, qui possèdent de tels domaines
SH2. Les Stats sont à la fois des protéines
cytoplasmiques de la transmission du signal
et des facteurs de transcription, fonctions à
l’origine de leur dénomination : Signal
Transducer and Activator of Transcription.
Parmi les sept membres de la famille des
Stats, le PRLR active Stat1, Stat3 et, de
manière prépondérante, Stat5 (appelé initia-
lement MGF pour Mammary Gland Fac-
tor). Interagissant avec le complexe PRLR/
JAK2, les Stats sont phosphorylées à leur
tour par la kinase, puis se dissocient du
récepteur et migrent sous forme dimérique
dans le noyau, où elles activent directement
la transcription de gènes cibles de la PRL
(figure 2). Par exemple, dans la cellule épi-
théliale mammaire, Stat5 transactive les
gènes codant pour les protéines du lait
(caséines, lactoglobuline, etc.). La voie
impliquant la phosphorylation sur tyrosine
successivement des kinases de la famille
JAK, des récepteurs et des Stats, est com-
mune aux récepteurs de cytokines et porte le
nom de “voie JAK/Stat”. Bien que cette cas-
cade soit sans doute primordiale dans la
signalisation du PRLR, d’autres voies,
impliquant d’autres kinases, sont également
activées par ce récepteur. À titre d’exemple,
nous pouvons citer certains membres de la
famille des tyrosines kinases Src ou encore
la cascade des MAP kinases (4). Enfin,
puisque l’un des objectifs de cette revue est
de replacer la PRL dans le contexte com-
plexe des facteurs de prolifération tumorale
mammaire, il est important de noter que les
voies de signalisation du PRLR et des
récepteurs stéroïdes, notamment le récep-
teurs aux estrogènes, présentent certaines
connexions (cross-talk). Cet effet implique,
entre autres, des interactions entre ces
récepteurs nucléaires et Stat5 (6).
Vers une nouvelle perception
de l’hormone prolactine ?
Au cours de la décennie écoulée, de nom-
breuses observations importantes ont été
réalisées, ce qui nous amène aujourd’hui à
quelque peu revoir la manière dont la PRL
doit être considérée en physiopathologie.
Nous nous limiterons ici à la description des
observations les plus significatives, en nous
appuyant essentiellement sur celles qui per-
mettront de rediscuter la place que l’on peut
accorder à la PRL dans certaines patholo-
gies liées aux paramètres endocriniens.
D’une part, nous survolerons l’ensemble
des données récemment obtenues grâce à
divers modèles animaux (souris transgé-
niques, knockout) qui ont permis de “ré-
ajuster” la liste des tissus cibles de la PRL,
bien plus diversifiés que la seule glande
mammaire, mais peut-être pas aussi nom-
breux que pourrait le laisser croire la littéra-
ture (4). D’autre part, nous discuterons plus
en détail de l’importance présumée de la
PRL d’origine extra-hypophysaire et, en
corollaire, de son mécanisme d’action auto-
crine-paracrine dans certains tissus et/ou
contextes particuliers. Ces notions nous
amèneront enfin à discuter de l’utilité théra-
peutique éventuelle d’antagonistes de la
PRL, dont le développement et la caractéri-
sation ont découlé d’une étude structure-
fonction détaillée de l’hormone, entamée
par notre groupe depuis une dizaine d’an-
nées (1).
Multiplicité des tissus cibles
de la PRL
Au début des années 70, Charles Nicoll
décrivait 85 actions différentes pour la PRL,
les mieux connues étant son activité biolo-
gique sur le développement mammaire et
l’induction de la sécrétion lactée, ainsi que
son action lutéotrope sur l’ovaire. Dans une
revue récente, nous avons recensé dans la
littérature quelque 300 fonctions différentes
attribuées à cette hormone, toutes espèces
confondues, ce qui dépasse de loin l’en-
semble des actions de toutes les autres hor-
mones hypophysaires réunies (4). Ces fonc-
tions biologiques de la PRL regroupent les
actions sur la reproduction, les échanges
hydro-électrolytiques, les actions endocri-
niennes et métaboliques, les effets sur la
Figure 2. Principales voies de transmission du signal intracellulaire activées par le PRLR.
Le PRLR active de multiples cascades de signalisation intracellulaires, impliquant notamment les protéines
de la voie JAK/Stat, des MAP kinases et des Src. De nombreuses autres voies non représentées ici sont égale-
ment activées et ont été décrites par ailleurs ( 4).

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume V, n° 6, novembre-décembre 2001
273
Nouvelles approches
croissance et le développement, le contrôle
du comportement (essentiellement mater-
nel), et, enfin, l’immunomodulation. La réa-
lité physiologique de certaines de ces fonc-
tions doit cependant être regardée avec
prudence, notamment lorsqu’elles ont été
observées dans des contextes éloignés de la
physiologie (cellules transfectées par
exemple), mais sans doute plus encore lors-
qu’elles ont été déduites de modèles ani-
maux classiques dont on connaît aujour-
d’hui les limites, voire les biais. C’est le
cas, par exemple, des modèles animaux trai-
tés par des analogues dopaminergiques ou
hypophysectomisés, qui s’avèrent incom-
plets dans l’inhibition de la source endogè-
ne de prolactine puisque sans effet sur la
synthèse extra-hypophysaire de l’hormone
(voir paragraphe suivant), ou encore de sou-
ris naines Snell-dwarf (dw/dw) présentant
une déficience hypophysaire dépassant la
seule PRL (la GH et la TSH sont également
absentes).
Au cours des cinq dernières années, des
modèles animaux mieux contrôlés ont été
développés et analysés : il s’agit de souris
knockout dont les gènes codants pour la
PRL (7) ou son récepteur (8) ont été invali-
dés, ou encore de souris transgéniques dans
le génome desquelles le gène de la PRL a
été inséré, conduisant à la surexpression de
l’hormone (9). En résumé, l’analyse phéno-
typique de ces modèles animaux a permis i)
de confirmer les actions historiquement
décrites de la PRL sur la lactation et la
reproduction, ii) de mettre en lumière de
nouvelles actions/tissus cibles de la PRL et,
enfin, iii) de replacer certaines actions pré-
cédemment attribuées à la PRL au rang de
fonctions sans doute modulées, mais certai-
nement pas contrôlées par l’hormone.
La fonction lactotrope historiquement
reconnue pour la PRL a été confirmée non
seulement par les modèles d’invalidation
des gènes de la PRL et du PRLR, mais éga-
lement par celui de Stat5a, une des molé-
cules essentielles dans la transmission du
signal intracellulaire par le PRLR. Les
femelles PRL–/–ou PRLR–/–étant stériles, la
lactation ne peut évidemment pas s’observer
chez ces animaux. Plus surprenant, les
jeunes femelles hétérozygotes PRLR+/–ne
peuvent allaiter correctement, indiquant que
le seuil d’expression du PRLR nécessaire au
développement fonctionnel de la glande
mammaire et à une lactation correcte ne
peut être obtenu avec un seul allèle PRLR.
En revanche, dès la deuxième gestation, la
lactation devient possible chez ces mêmes
femelles PRLR+/–(8), ce qui suggère que la
glande mammaire acquiert un nombre de
canaux et d’alvéoles compatible avec une
lactation efficace après plusieurs cycles
œstraux d’imprégnation hormonale et une
nouvelle gestation. Outre ces troubles de
lactation, assez attendus, les femelles
PRLR–/–sont stériles et présentent un déficit
d’implantation des embryons fécondés, tra-
duisant le rôle essentiel de la PRL dans les
fonctions de reproduction chez la souris. La
gestation de ces souris peut être partielle-
ment restaurée par l’administration de pro-
gestérone exogène, la synthèse de progesté-
rone (endogène) étant, chez la souris (mais
pas chez l’homme), sous contrôle d’un sti-
mulus prolactinique (et donc très basse chez
les animaux PRLR–/–). Ces observations
suggèrent que certaines déficiences des
fonctions reproductives humaines pour-
raient, outre les hormones gonadotropes,
impliquer également la PRL, même si tout
reste à démontrer dans ce domaine.
À côté de ces fonctions typiques confirmées
sans ambiguïté, les modèles knockout ont
établi de nouvelles cibles de la PRL, comme
le remodelage osseux. Ainsi, un retard de
développement dans la mise en place du
squelette des animaux PRLR–/–a-t-il été
observé. Chez l’adulte, on observe aussi une
densité minérale osseuse et un taux d’appo-
sition minérale plus faibles ainsi qu’une
hypercalcémie, par rapport aux souris sau-
vages, ce qui a pour conséquence une vites-
se réduite du remodelage osseux (10). Plus
récemment, une altération du métabolisme
adipeux a également été observée chez les
souris PRLR–/–âgées (< 8 mois), avec un
dimorphisme sexuel marqué puisque ce sont
les femelles qui sont affectées. Leur masse
adipeuse abdominale est significativement
réduite, de même que le taux circulant de
leptine, suggérant un rôle de la prolactine
sur le métabolisme et la croissance du tissu
adipeux. À l’inverse des phénotypes obser-
vés chez les animaux knockout, qui mettent
en lumière les déficiences résultant de l’ab-
sence d’activation du PRLR, les souris
transgéniques pour la PRL reflètent les
conséquence d’une surexpression de l’hor-
mone et, en corollaire, de la suractivation de
son récepteur. Ainsi, ces souris transgé-
niques développent des hyperplasies mam-
maires plus rapidement que les souris
contrôles (9), ce qui rejoint les observations
faites in vitro quant au rôle prolifératif de la
prolactine sur les cellules épithéliales mam-
maires (tumorales), cibles par excellence de
la PRL. En revanche, l’hyperplasie prosta-
tique observée chez ces souris démontre
l’action prépondérante de la PRL sur ce
tissu, jusque-là timidement suggérée (11).
Bien que encore préliminaires et réalisées
chez la souris, ces observations ouvrent la
porte à de nouvelles orientations de
recherches qui pourraient permettre de
mettre en évidence le rôle éventuel de la
PRL dans un contexte physiopathologique
élargi (12).
Enfin, si le spectre fonctionnel de la PRL
demeure vaste, certaines des actions qui lui
sont classiquement attribuées n’ont pas été
totalement confirmées à la lumière de ces
modèles murins. L’exemple typique concer-
ne l’une des fonctions actuellement les plus
controversées de la PRL, à savoir son activi-
té sur le système immunitaire. Au cours de
ces 30 dernières années, une multitude
d’études réalisées tant in vitro que sur des
modèles animaux aujourd’hui remis en
question (traitement par analogues dopami-
nergiques, hypophysectomie, etc.), ont
conclu à une fonction immunomodulatrice
de la PRL. Cependant, aucune altération des
réponses immunitaires n’a été décelée chez
les animaux knockout pour le PRLR ou la
PRL, suggérant que l’hormone n’exerce pas
d’action spécifiquement indispensable au
développement ou au fonctionnement d’une
sous-population particulière du système
immunitaire. Il a été proposé que l’action
stimulatrice de la PRL sur la plupart des
populations cellulaires immunitaires soit
relativement modeste en condition non
 6
6
 7
7
 8
8
 9
9
1
/
9
100%