L Gestion des effets indésirables du sunitinib dans les cancers digestifs

124 | La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 3 - mai-juin 2011
DOSSIER THÉMATIQUE
Gestion des thérapies ciblées
Gestion des effets indésirables
du sunitinib dans les cancers
digestifs
Management of side-effects associated with sunitinib
therapy for patients with GI cancers
Bruno Landi*, Florian Scotté**, Olivier Bouché***
* Service de gastro-entérologie et
oncologie digestive, hôpital euro-
péen Georges-Pompidou, Paris.
** Service d’oncologie médicale,
hôpital européen Georges-Pompi-
dou, Paris.
*** Service de gastro-entérologie et
oncologie digestive, hôpital Robert-
Debré, CHU de Reims.
Le sunitinib (Sutent®) est un inhibiteur oral de
tyrosine kinase agissant sur plusieurs récep-
teurs tyrosine kinases transmembranaires
comprenant notamment les récepteurs du VEGF
et les récepteurs KIT/PDGFR. L’inhibition de l’acti-
vité de ces récepteurs va bloquer la transduction du
signal normalement transmis par leur activation.
Cela permet en théorie un double blocage, de la
prolifération et de la survie des cellules tumorales,
mais aussi une inhibition de la principale cytokine
responsable de la néo-angiogenèse tumorale. La
contribution respective de ces deux activités à l’effet
antitumoral du sunitinib reste débattue. L’effi cacité
clinique du sunitinib a été démontrée initialement
dans le cancer du rein à un stade avancé. En onco-
logie digestive, le sunitinib est indiqué dans les
tumeurs stromales gastro-intestinales (GIST) non
résécables ou métastatiques après échec d’un trai-
tement par imatinib et, depuis peu, dans les tumeurs
neuroendocrines du pancréas (pNET) métastatiques
ou non résécables (1, 2).
Posologie
Dans les GIST avancées, la dose de sunitinib utilisée
dans l’étude de phase III était de 50 mg/j en une
prise, pendant 4 semaines consécutives, suivies
d’une fenêtre thérapeutique de 2 semaines (schéma
on-off), correspondant à un cycle de 6 semaines (1).
Ce schéma avait été développé initialement dans
le cancer du rein. En pratique, on utilise souvent
le sunitinib en continu à 37,5 mg/j, sur les données
d’une étude de phase II qui a suggéré une effi cacité
similaire de ce schéma d’administration avec un meil-
leur profi l de tolérance, certains effets indésirables
étant dose-dépendants (2). C’est ce même schéma
en continu à 37,5 mg/j en une prise quotidienne qui
est recommandé dans les pNET métastatiques (3).
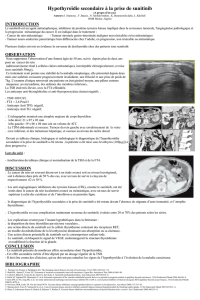
Principaux effets indésirables
Le sunitinib entraîne fréquemment des effets
indésirables, de nature très variée (tableau I)
[4]. Ceux-ci sont rarement sévères (tableau II),
en général aisément gérables grâce aux traite-
Tableau I. Principaux effets indésirables du sunitinib.
Effets indésirables
Tube digestif Nausées
Diarrhée
Peau et phanères Syndrome main-pied
Xérose cutanée
Rash cutané
Œdème péri-orbitaire
Coloration jaunâtre de la peau
Décoloration des cheveux
Bouche Mucite, dysgueusie, glossodynie
Système cardiovasculaire Hypertension
Allongement de l’espace QT
Baisse de la fraction d’éjection ventriculaire gauche
Hématologiques et généraux Asthénie
Cytopénies
Hypophosphatémie
Thyroïde Hypothyroïdie
▸▸▸/▸▸▸

La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 3 - mai-juin 2011 | 125
Points forts
»Les effets indésirables du sunitinib sont variés mais rarement sévères.
»
Les effets indésirables les plus fréquents sont les troubles digestifs, une asthénie, des lésions cutanées
et/ou buccales, une hypertension.
»Des anomalies cardiaques, une cytopénie et une hypothyroïdie sont possibles.
»
Leur gestion est essentielle pour assurer une bonne compliance au traitement, préalable à son efficacité.
Mots-clés
Sunitinib
Effets indésirables
GIST
Tumeurs
neuroendocrines
dupancréas
Keywords
Sunitinib
Side-effects
GIST
Pancreatic neuroendocrine
tumors
ments symptomatiques. Les effets indésirables
peu sévères le plus fréquemment observés sont
des troubles digestifs, une asthénie, des lésions
cutanées et/ou buccales, une hypertension arté-
rielle (HTA). Le syndrome main-pied (SMP) et la
diarrhée peuvent être sévères chez environ 5 % des
patients. Des anomalies cardiaques, une cytopénie
et une hypothyroïdie sont possibles. Il n’a pas été
noté, dans les études avec le sunitinib, de troubles
de la cicatrisation malgré une action anti-VEGF, et,
de ce fait, l’interruption du traitement peut être
brève en cas de chirurgie. Certains auteurs préco-
nisent cependant, par sécurité, un arrêt du traite-
ment une semaine avant une chirurgie majeure
programmée (5).
Principes généraux
de la prise en charge
Plusieurs facteurs, dont la durée et la dose du trai-
tement par sunitinib, conditionnent son effi cacité
et sa tolérance. La tolérance a un impact direct sur
l’observance et la qualité de vie. La gestion des effets
indésirables est donc fondamentale. Le patient doit
être informé des effets secondaires, éduqué quant à
leur prise en charge, et régulièrement suivi, en parti-
culier en début de traitement. La remise d’un carnet
d’information et de liaison spécifi que et l’implication
du médecin traitant sont essentiels. Une consultation
adaptée d’annonce d’infi rmière peut être une option
particulièrement utile.
Tableau II. Effets indésirables liés au sunitinib rapportés dans les études portant sur des patients atteints de GIST et dans l’étude de phase III sur des patients
atteints de TNE pancréatiques métastatiques (chiffres arrondis à 0,5 %) [d’après 3].
GIST
50 mg/j - 4 semaines sur 6
TNE
37,5 mg/j
Effets indésirables Tous grades Grade 3-4 Tous grades Grade 3-4
Diarrhée 42,5 % 5,5 % 59 % 5 %
Nausées 37 % 3 % 45 % 1 %
Asthénie 65 % 15 % 34 % 5 %
Syndrome main-pied 24 % 6 % 23 % 6 %
Rash cutané 14,5 % 1 % 18 % 0
Hypertension artérielle 23 % 10 % 26 % 10 %
Stomatite 20,5 % 1,5 % 22 % 4 %
Neutropénie 18,5 % 10 % 29 % 12 %
Thrombopénie 15 % 5 % 17 % 4 %
Hypothyroïdie 13,5 % 1,5 % 7 % Non précisé
Dysgueusie 18 % 0 20 % 0
Modifi cation ou coloration jaune ou de la peau 33 % 0 Non précisé
Modifi cation de la couleur des cheveux 7 % 0 29 % 1 %
Tableau III. Adaptation des doses de sunitinib en fonction des effets indésirables (d’après les RCP).
Effets indésirables hématologiques Conduite pratique
Grade 1-2 Poursuite à la même dose
Grade 3 Arrêt jusqu’à grade ≤ 2
Reprise à la même dose
Grade 4 Arrêt jusqu’à grade ≤ 2
Reprise à un palier de dose inférieur
Effets indésirables non hématologiques Arrêt jusqu’à grade ≤ 2
Reprise à la même dose ou à un palier de dose inférieur selon l’effet indésirable

126 | La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 3 - mai-juin 2011
Gestion des effets indésirables du sunitinib dans les cancers digestifs
DOSSIER THÉMATIQUE
Gestion des thérapies ciblées
Des interruptions transitoires et des ajustements de
doses par paliers de 12,5 mg peuvent être nécessaires
selon la tolérance au traitement (tableau III). Le
rapport bénéfi ce/risque doit être évalué avant toute
modifi cation de dose, un équilibre entre effi cacité
et qualité de vie du patient étant nécessaire. En
pratique, la posologie ne devra pas être inférieure
à 25 mg/j. En cas d’utilisation du schéma on/off, les
effets secondaires diminuent nettement durant les
périodes de repos.
Les examens paracliniques recommandés avant et
pendant le traitement par sunitinib sont indiqués
dans le tableau IV.
Il convient de systématiquement tenir compte du
risque d’interactions médicamenteuses avec des
traitements concomitants. L’administration conco-
mitante avec des inducteurs puissants du CYP3A4
(tels que la rifampicine) doit être évitée, car elle
peut entraîner une diminution des concentrations
plasmatiques du sunitinib. Il en est de même avec
des inhibiteurs puissants du CYP3A4 (tels que le
kétoconazole), qui peuvent induire une augmenta-
tion des concentrations plasmatiques du sunitinib.
Il convient aussi d’éviter le pamplemousse et son
jus, qui modifi ent l’activité du CYP3A4.
Toxicité digestive et muqueuse
Les troubles digestifs (diarrhée, dyspepsie, nausées,
vomissements et anorexie) mais aussi des muqueuses
(xérose buccale, mucite, dysgueusie, glossodynie,
enrouement, dysphonie, épistaxis) sont fréquents
(> 30 % des patients). La prise en charge de ces effets
indésirables doit être précoce. Elle consiste en des
traitements symptomatiques classiques par conseils
diététiques, antidiarrhéiques, antiémétiques, bains
de bouche antiseptiques et dentifrices ne contenant
pas d’alcool. Une hyper-hydratation orale – voire
parentérale dans de rares cas – est nécessaire lors
d’une diarrhée. En cas de toxicité de grade 3, une
interruption provisoire du traitement est recom-
mandée (tableau III).
Lésions de la peau
et des phanères
Les modifi cations de la peau et des phanères sont
très variées sous sunitinib. Leur prise en charge
s’appuie largement sur des avis d’experts.
Le SMP se manifeste par des lésions érythémateuses
douloureuses hyperkératosiques, desquamatives et
fi ssuraires. Elles siègent sur les zones de pression,
comme les talons, et les zones de frottement des
chaussures. Certaines formes sont plus œdéma-
teuses et infl ammatoires. Une consultation précoce,
voire une prise en charge initiale par un podologue-
pédicure, est importante, car l’intensité maximale
du SMP est observée dès la deuxième semaine du
traitement.
La prise en charge thérapeutique du SMP du sunitinib
est différente de celle du SMP chimio-induit, observé
par exemple avec la capécitabine (6, 7). Le traite-
ment est d’abord préventif : décapage doux par un
pédicure, suivi de l’application de crèmes émollientes
et kératolytiques, en cas d’hyperkératose plantaire
préexistante. Il faut éviter les chaussures trop serrées,
les talons trop hauts ; le port de chaussettes en coton
et de semelles absorbantes est conseillé. Le traite-
ment curatif repose sur les topiques kératolytiques
à base d’urée ou d’acide salicylique (20 à 30 % selon
l’épaisseur de la kératose), plutôt en préparations
magistrales (tableau V), les spécialités commerciales
n’étant pas remboursées (par exemple, crème pieds
Xérial
®
30 ou 50). Il peut être utile d’y associer un
dermocorticoïde (par exemple, Diprosone
®
) lorsque
les lésions sont inflammatoires. Des compresses
froides peuvent avoir un effet antalgique dans les
formes sévères. En cas de SMP de grade 3 ou 4,
Tableau IV. Examens paracliniques recommandés avant et pendant le traitement par sunitinib.
Avant le début du traitement NFS
TSH/T4
Protéinurie par bandelette urinaire (BU)
Bilan cardiovasculaire TA, ECG, échographie cardiaque (FEVG)
En cours de traitement NFS, bilan hépatique, ionogramme créatinine tous les 14jours
pendant 1mois puis toutes les 4 à 6semaines
TSH/T4 si signe clinique d’appel
Bandelette urinaire à chaque cycle si HTA ou signe d’appel
néphrologique. Si BU = ++ faire protéinurie des 24h
TA : mesure régulière de préférence par automesure
à domicile, sinon régulièrement auprès du médecin traitant
et à chaque consultation
ECG et/ou FEVG si facteurs de risque cardiovasculaire ou
signe clinique*
* antécédents de maladie coronarienne, d’insuffi sance cardiaque ou troubles du rythme.
FEVG : fraction d’éjection ventriculaire gauche.
Tableau V. Exemples de préparations magistrales kératolytiques* pour la prise en charge du
syndrome pied-main lié au sunitinib (d’après 4).
À base de vaseline Vaseline (Codex®) salicylée à 20% ou 30% une fois par jour (en
occlusif le soir avec Tegaderm® ou fi lm alimentaire)
À base d’urée Urée 40 g, eau purifi ée 40 g, Excipial® lipocrème 20 g
* Il faut noter sur l’ordonnance “prescription médicale à but thérapeutique en l’absence de spécialité
équivalente disponible” pour que le produit soit remboursé.

La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 3 - mai-juin 2011 | 127
DOSSIER THÉMATIQUE
une consultation dermatologique est souhaitable,
et une interruption de traitement est nécessaire,
suivie éventuellement d’une réduction secondaire
des doses. Néanmoins, les récidives de SMP étant
rares après quelques semaines de traitement, celui-ci
peut souvent, en pratique, être repris à pleine dose.
Un rash maculeux et/ou papuleux peut se déve-
lopper sur n’importe quelle partie du corps. Un prurit
est possible, souvent en rapport avec une xérose,
et nécessite une hydratation cutanée. Des rashs
inguino-scrotaux invalidants ont été décrits. Un trai-
tement anti-histaminique et/ou une corticothérapie
locale se discutent au cas par cas. Les autres effets
indésirables dermatologiques possibles sont une
dépigmentation ou une coloration jaune de la peau,
une dépigmentation des cheveux, une alopécie, des
hémorragies sous-unguéales asymptomatiques en
forme de ligne, ainsi que des œdèmes, notamment
périorbitaires.
Asthénie
L’asthénie est un effet indésirable commun, en parti-
culier à la dose de 50 mg/j, le plus souvent sans
cause associée. Un dosage de l’hémoglobine, un
bilan martial, hémorragique, nutritionnel et un bilan
thyroïdien sont cependant à réaliser, car le sunitinib
peut induire une anémie ou une hypothyroïdie. Un
bilan thyroïdien est aussi à prescrire en cas d’autre
point d’appel clinique évoquant une hypothyroïdie,
voire, plus rarement, une hyperthyroïdie (2).
Hypertension et toxicité rénale
L’incidence de l’HTA est d’environ 25 % dans
les études pour cancer du rein, GIST ou pNET.
Une HTA était pratiquement constante dans
une étude en cas d’automesures à domicile (8).
La pression artérielle (PA) doit en principe être
surveillée de façon hebdomadaire, si possible par
automesures, pendant les six premières semaines
de traitement, puis à chaque consultation. Une
HTA sévère (pression systolique > 200 mmHg ou
pression diastolique > 110 mmHg) est survenue
chez moins de 5 % des patients présentant des
tumeurs solides (9).
Le traitement de cette HTA est similaire à celui
de l’HTA induite par le bévacizumab (lire l’article :
Gestion des effets indésirables du bévacizumab,
p. 102). Cependant, les inhibiteurs calciques,
notamment non dihydropyridiques (vérapamil et
diltiaziem), sont déconseillés du fait d’un risque
d’interaction au niveau de l’isoenzyme P3A4 du
cytochrome P450. Une interruption temporaire
du traitement est recommandée chez les patients
atteints d’HTA sévère non contrôlée médicalement.
Le traitement peut être repris dès que l’HTA est
correctement contrôlée.
Des cas isolés de microangiopathies thrombo-
tiques, de néphropathies interstitielles aiguës et de
syndrome néphrotique ont été décrits. La recherche
systématique de protéinurie par bandelette urinaire
est recommandée initialement, puis en cas d’HTA ou
de point d’appel orientant vers une possible toxicité
rénale.
Toxicité cardiaque (tableau VI)
Il est important, avant de commencer le traitement
par sunitinib, de préciser les pathologies et les
facteurs de risque cardiaques, ainsi que d’évaluer la
fonction cardiaque (9). Le sunitinib peut entraîner
une diminution de la fraction d’éjection ventricu-
Tableau VI. Gestion de la toxicité cardiovasculaire du sunitinib.
HTA Diminution de la FEVG/
insuffi sance cardiaque
Allongement de l’espace QT
Surveillance Mesure régulière de la TA, de préférence par
automesure à domicile, sinon régulièrement
auprès du médecin traitant et à chaque
consultation
Signes cliniques d’insuffi sance cardiaque
FEVG périodique si antécédents de maladie
coronarienne ou d’insuffi sance cardiaque
ECG à chaque cycle si trouble du
rythme préexistant
Bilan hydroélectrolytique
Traitement Mesures hygiénodiététiques
Modifi cation ou introduction d’un traitement
antihypertenseur
Suivi cardiovasculaire et traitement appro-
priés
Suivi cardiovasculaire et traitement
appropriés
Adaptation de la dose
de sunitinib
Interruption transitoire si HTA sévère non
contrôlée
Arrêt si signes d’insuffi sance cardiaque ou si
diminution de la FEVG de 20 %
Arrêt sur avis cardiologique
FEVG : fraction d’éjection ventriculaire gauche.

128 | La Lettre de l’Hépato-gastroentérologue • Vol. XIV - n° 3 - mai-juin 2011
Gestion des effets indésirables du sunitinib dans les cancers digestifs
DOSSIER THÉMATIQUE
Gestion des thérapies ciblées
laire gauche (FEVG) dans environ 10 % des cas,
avec environ 3 % de décompensations cardiaques
sévères, souvent favorisées par la présence d’une
HTA (4). Dans les essais cliniques, une diminu-
tion de la FEVG supérieure ou égale à 20 %, et en
dessous de la limite inférieure de la normale, est
survenue chez environ 2 % des patients atteints de
GIST, chez 4 % des patients atteints de cancer du
rein traités par sunitinib et chez 2 % des patients
atteints de GIST recevant un placebo. L’insuffi-
sance cardiaque et l’altération de la FEVG sont
généralement, mais pas toujours, réversibles après
arrêt du sunitinib (5). Le sunitinib peut aussi favo-
riser un allongement de l’espace QT. Il est donc à
utiliser avec précaution en cas de notion préalable
d’allongement de l’espace QT ou de prise médi-
camenteuse concomitante le favorisant (notam-
ment, certains antiarythmiques, psychotropes,
antibiotiques ou antiémétiques). Une mesure de
la PA, un ECG et une évaluation de la FEVG sont
donc recommandés avant traitement chez tous
les patients, puis régulièrement (classiquement
toutes les 6 semaines pour l’ECG et tous les 3 mois
pour la FEVG en cas de comorbidités cardiovascu-
laires) et, bien sûr, en cas de symptôme d’appel (9)
[tableau VI].
Effets indésirables
hématologiques
Une neutropénie ou une thrombopénie de grade 3-4
sont possibles dans respectivement 10 et 5 % des cas
environ (tableau I). Ces neutropénies ne sont cepen-
dant pas particulièrement associées à des épidodes
de fi èvre ou de sepsis. Des hémorragies sont possibles
sous traitement, principalement des épistaxis, plus
rarement des gingivorragies, et exceptionnellement
des hémorragies intratumorales. Il faut savoir que la
coumadine doit être utilisée avec prudence, à la fois
du fait des interactions directes potentielles avec la
coagulation et le cytochrome P450. Dans ce cas, un
suivi précis des variations de l’INR est indispensable.
Autres effets indésirables rares
D’autres effets secondaires rares ou non attendus
ont été rapportés, pour certains après la mise sur
le marché du médicament : perforation digestive,
pancréatite, hépatite, convulsions, leucoencéphalo-
pathie postérieure réversible. Cette liste n’est pas
exhaustive, et il convient de contacter son centre
de pharmacovigilance au moindre doute. ■
1. Demetri GD, Van Oosterom AT, Garrett CR et al. Effi cacy
and safety of sunitinib in patients with advanced gastrointes-
tinal stromal tumour after failure of imatinib: a randomised
controlled trial. Lancet 2006;368:1329-38.
2. Thésaurus national de cancérologie digestive : GIST.
Version 2011. Disponible en ligne sur le site http://www.
snfge.asso.fr
3. Raymond E, Dahan L, Raoul JL et al. Sunitinib malate for
the treatment of pancreatic neuroendocrine tumors. N Engl
J Med 2011;364:501-13.
4. Bouché O, Scaglia E, Reguiai Z, Singha V, Brixi-Benman-
sour H, Lagarde S. Biothérapies ciblées en cancérologie
digestive : prise en charge de leurs effets secondaires.
Gastroenterol Clin Biol 2009;33:306-22.
5. Schwandt A, Wood LS, Rini B, Dreicer R. Management of
side effects associated with sunitinib therapy for patients
with renal cell carcinoma. Onco Targets Ther 2009;2:51-61.
6. Autier J, Mateus C, Wechsler J, Spatz A, Robert C. Effets
secondaires cutanés du sorafénib et du sunitinib. Ann
Dermatol Venereol 2008;135:148-53.
7. Lacouture ME, Reilly LM, Gerami P, Guitart J. Hand foot
skin reaction in cancer patients treated with the multikinase
inhibitors sorafenib and sunitinib. Ann Oncol 2008;19:1955-
61.
8. Azizi M, Chedid A, Oudard S. Home blood-pressure
monitoring in patients receiving sunitinib. N Engl J Med
2008;358:95-7.
9. Halimi JM, Azizi M, Bobrie G et al. Effets vasculaires et
rénaux des médicaments anti-angiogéniques. Nephrol Ther
2008;4:602-15.
Références bibliographiques
Lab’infos
Cet essai, sponsorisé par Abbott, a pour ambition
de comparer deux algorithmes de prise en charge de
patients atteints de la maladie de Crohn, non encore
traités par immunosuppresseurs ou par biothérapie. Les
patients seront traités soit de façon habituelle – le but
étant d’obtenir une rémission clinique – soit de façon
Démarrage de l’essai CALM
à obtenir une rémission complète clinique, biologique
et endoscopique avec escalade thérapeutique si néces-
saire, l’anti-TNF utilisé étant l’Humira
®
. D’une durée
de 1an, l’essai inclura 240 patients en Europe et au
Canada et sera dirigé par le professeur J.F. Colombel
(Lille - New York).
 6
6
1
/
6
100%