Les nouvelles approches pharmacologiques du traitement de l’anxiété

L
a prise en charge des troubles mentaux représente, en ce
début de XXIesiècle, l’un des plus importants défis de
santé publique pour la population mondiale. Ces patho-
logies sont, en effet, particulièrement fréquentes, tant en popula-
tion générale (quel que soit le pays, une personne sur quatre sera
Les nouvelles approches pharmacologiques du traitement
de l’anxiété
Designing novel anxiolytic drugs: from receptors to ligands?
●
P. Martin*
* Département de psychiatrie, unité de recherche, université Pierre-et-Marie-
Curie, hôpital Saint-Antoine, Paris.
Les troubles anxieux sont les maladies psychiatriques les
plus courantes. L’anxiété engendre des dysfonctionnements
neurobiologiques, sans que les mécanismes en soient
complètement connus. Le système GABAergique (notam-
ment les récepteurs GABA-A) paraît jouer un rôle impor-
tant dans la physiopathologie du stress, de l’anxiété et des
troubles dépressifs. L’avancée des nouvelles connaissances
neurobiologiques sur les troubles anxieux a entraîné la
recherche de nouveaux traitements comme alternative aux
benzodiazépines utilisées depuis plus de 40 ans. Les molé-
cules actives sur les sous-unités du récepteur GABA-A
semblent présenter un grand intérêt pour le traitement des
patients anxieux. Par ailleurs, l’utilisation des anticonvul-
sivants (tiagabine, prégabaline, etc.) dans ces troubles
semble être une voie de recherche intéressante, comme cela
a été montré dans différentes études cliniques en ouvert ou
en double aveugle. Parmi ces voies de recherche nouvelles,
certaines concernent les neuropeptides, les molécules ayant
une affinité pour certains sous-types de récepteurs séroto-
ninergiques, ou encore les antagonistes du glutamate. Tou-
tefois, il n’a pour l’instant pas encore été déterminé si ces
molécules devaient être utilisées en première intention, ou
en cas de résistance ou de non-réponse aux traitements
classiques.
Mots-clés : Anxiolytiques – Systèmes GABAergiques – Sous-
unités GABA – Antagoniste NMDA – Modulateur des canaux
calciques voltage-dépendant (s-u α2 δ) – GABAmimétiques.
R É S U M É
R É S U M É
Anxiety disorders are the most common type of psychiatric ill-
nesses. Anxiety stems from and perpetuates dysregulations of
neurobiological systems, but the exact mechanisms of anxiety
disorders are still only partially understood. The gamma amino-
butyric acid (GABA) system (including GABA-A receptors)
appears to play an important role in the regulation of psycho-
logic responses to stress, anxiety and depressive disorders.
Recent advances in the understanding of the neurobiologic fea-
tures of anxiety disorders have led to the identification of new
treatments that may prove to be useful alternatives to benzo-
diazepines, which have been the mainstay of anxiety treatment
for more than 40 years. Pharmacologic agents designed to
modulate the effects of GABA, such as the subunit-modulators,
have shown promise in the treatment of anxious patients. On
the other hand, the psychotropic use of anticonvulsants (tiaga-
bine, pregabalin, etc.) is an active area of research, with seve-
ral case reports and open and/or double-blind trials sugges-
ting their potential efficacy in various anxiety disorders. Other
novel strategies concerning glutamate antagonists, neuropep-
tides and serotoninergic ligands have attracted greater interest
as potential anxiolytics. However, it is unclear at this point
whether their place will be as first-line agents, as augmenting
strategies, or as medications used in cases of treatment resis-
tance or non response to traditional pharmacotherapy.
Keywords: Anxiolytic drugs – GABAergic systems – GABA-A-R
subtypes – Antagonist NMDA – Voltage-dependent calcium
channel modulator (α2 δprotein) – GABA-like drugs.
SUMMARY
SUMMARY
affectée par un ou plusieurs troubles mentaux ou du comporte-
ment au cours de sa vie) qu’au sein des populations médicalisées
(20 à 30 % des consultants de médecine générale présentent des
problèmes psychopathologiques).
Ces troubles sont, par ailleurs, caractérisés par un très fort impact
en termes de morbidité et de mortalité. En 2001, l’OMS, a ainsi
dénombré quatre maladies mentales (troubles dépressifs unipo-
laires, troubles liés à l’alcool, schizophrénie, trouble bipolaire)
La Lettre du Psychiatre - vol. II - n° 1 - janvier-février 2006
28
DOSSIER THÉMATIQUE
Mise au point

parmi les dix maladies générant la plus forte mortalité et le plus
important handicap, les troubles mentaux étant globalement res-
ponsables de 10,5 % du nombre total d’années de vie en bonne
santé perdues.
L’OMS a par ailleurs souligné les progrès considérables réalisés au
cours des 30 dernières années dans les domaines des neurosciences
et de la médecine du comportement (1). Après la spectaculaire per-
cée de la psychopharmacologie à partir des années 1960, les avan-
cées plus récentes de la génétique et de la biologie moléculaire ont
en effet permis de mieux caractériser le support organique de cer-
taines maladies mentales (schizophrénie, trouble affectif bipolaire,
par exemple), tandis que le développement de la neuro-imagerie et
des neurosciences cognitives a permis d’établir des liens entre cer-
taines activités cérébrales régionales et certains phénomènes men-
taux, normaux ou pathologiques.
Ces progrès devraient permettre le développement de nouveaux
médicaments, mais aussi de nouveaux traitements physiques tels
que la photothérapie, la stimulation magnétique transcrânienne
répétée (rTMS) ou la stimulation cérébrale profonde (SCP).
En santé mentale, les troubles anxieux représentent les affections
psychiatriques les plus répandues chez l’adolescent et l’adulte,
puisque l’on estime à près de 25 % la proportion de sujets ayant
subi un épisode de trouble anxieux sévère et/ou invalidant au cours
de leur vie (2). Toutefois, il demeure un certain nombre de ques-
tions quant à leur reconnaissance clinique, tant sur le plan de leur
classification que sur le plan du référentiel de stratégies thérapeu-
tiques, notamment médicamenteuses. Les classifications actuelle-
ment utilisées par la communauté scientifique internationale sont
celles de l’OMS et, surtout, celle de l’Association américaine de
psychiatrie (DSM-IV). Elles séparent les troubles anxieux en six
pathologies principales, qui se différencient par les sources de
l’anxiété ou par les stratégies utilisées pour tenter de la limiter.
En revanche, on peut dire qu’il existe des caractéristiques
communes à tous les troubles anxieux, c’est-à-dire un état d’hyper-
activité chronique du système nerveux sympathique, associé à une
hypervigilance consciente et préconsciente, ainsi que la présence de
nombreux évitements (de situations, d’images ou de pensées) qui
soulagent l’anxiété à court terme, mais la chronicisent à long terme
en validant les postulats anxiogènes. Ce contexte a conduit à l’éla-
boration de différents modèles, dont le modèle bio-psycho-social
est considéré comme le plus convaincant par les chercheurs et les
cliniciens. En effet, dans ce paradigme, pour qu’un trouble anxieux
existe et persiste, il faut que soient présents, à des degrés divers, une
vulnérabilité biologique (souvent innée), une trajectoire psycholo-
gique allant dans le sens du trouble (modèles parentaux eux-mêmes
anxieux, éducation trop protectrice, etc.) et un environnement social
facilitant (rapports sociaux de plus en plus exigeants).
Enfin, ces troubles sont assez souvent comorbides chez ces
patients de manière soit synchronique, soit diachronique, avec
une intensité qui peut aussi fluctuer dans le temps. De là la très
grande variété des tableaux cliniques rencontrés et la question de
savoir quel(s) traitement(s) semble(nt) le(s) plus approprié(s),
sachant qu’il se dégage au moins trois grands axes que sont l’édu-
cation et l’information des patients anxieux, les psychothérapies
et les traitements médicamenteux.
ASPECTS FONCTIONNELS DE L’ANXIÉTÉ
Support neuro-anatomiques
L’anxiété correspond à un état psychologique, physiologique et
comportemental signalant un danger, une menace ou un conflit,
qu’ils soient réels ou seulement perçus comme tels, et destiné à
déclencher une réponse adaptative. Par conséquent, l’anxiété,
comme la peur, est liée à la fois à notre évaluation subjective de
ces stimuli et à nos réactions physiologiques à l’environnement.
Bien que l’anxiété corresponde à une réaction adaptative natu-
relle, elle peut devenir pathologique, et interfère alors avec notre
capacité à faire face à notre environnement (3).
Force est encore de constater aujourd’hui que l’empirisme et
même des stratégies chimiothérapeutiques appropriées n’ont tou-
jours pas permis de formaliser précisément quels supports neu-
robiologiques pourraient rendre compte d’un état anxieux, et cela
même si de réels progrès ont été faits avec l’apport des neuro-
sciences et de l’imagerie cérébrale. Le rôle clé du système lim-
bique, et plus particulièrement de l’amygdale, de l’hippocampe,
du thalamus et des cortex préfrontal et cingulaire, a ainsi été mis
en évidence. Il est bien admis à l’heure actuelle que l’amygdale
constitue une structure primordiale pour l’étude des circuits de
l’anxiété, superposé à celui d’une émotion, la peur. Schémati-
quement, le processus évoqué pourrait être le suivant
(figure 1)
:
un stimulus sensoriel évoquant la présence d’un danger pour l’or-
ganisme va d’abord atteindre le thalamus. De là, il sera pris en
charge par deux voies parallèles : la voie thalamo-amygdalienne
(voie courte) et la voie thalamo-cortico-amygdalienne (voie
longue). La première véhicule une perception grossière et rapide
d’une situation puisque c’est une voie sous-corticale qui ne béné-
ficie pas de la cognition. Elle active l’amygdale qui, par l’entre-
mise de son noyau central, fait naître des réactions émotionnelles
avant même que l’intégration perceptuelle n’ait eu lieu et que le
système puisse se représenter complètement le stimulus.
Dans un deuxième temps, le traitement de l’information par la
voie corticale longue arrive à l’amygdale et précise si le simulus
est véritablement menaçant ou s’il n’y a pas lieu de s’inquiéter.
Pour ce faire, différents niveaux de traitement cortical sont néces-
saires. En effet, après un traitement des différentes modalités de
l’objet par le cortex sensoriel primaire, le cortex associatif “uni-
modal” fournit à l’amygdale une représentation de l’objet. À un
niveau d’analyse encore supérieur, le cortex associatif “polymo-
dal” conceptualise la chose et en informe également l’amygdale.
Cette représentation élaborée de l’objet peut alors être comparée
au contenu de la mémoire explicite grâce à l’hippocampe, qui
entretient lui aussi des liens étroits avec l’amygdale.
C’est l’hippocampe qui permet en premier lieu l’apprentissage
du caractère dangereux d’un objet ou d’une situation grâce à la
mémoire explicite. L’hippocampe est aussi particulièrement sen-
sible à l’encodage du contexte associé à une expérience aversive.
C’est lui qui fait qu’un stimulus peut devenir une source de peur
conditionnée, mais également les objets autour, la situation ou le
lieu où il se produit. La perception d’un danger imminent pour-
suit alors le travail d’activation de l’amygdale, dont les patterns
La Lettre du Psychiatre - vol. II - n° 1 - janvier-février 2006
Mise au point
29

de décharge vont activer les structures efférentes responsables des
manifestations de la peur, comme la fréquence cardiaque et la
pression sanguine élevées, les mains moites, la bouche sèche, les
muscles tendus, etc. En résumé, les lésions ou un dysfonctionne-
ment de l’amygdale empêchent les réponses conditionnées ; les
lésions ou un dysfonctionnement de l’hippocampe empêchent
l’apprentissage. Enfin, le locus coeruleus joue un rôle de filtrage
des stimuli de peur.
On peut dire que l’imagerie cérébrale a permis de progresser dans
la compréhension des mécanismes physiopathologiques des
troubles anxieux et de déterminer plus précisément quelles struc-
tures étaient impliquées de manière privilégiée en fonction du
trouble anxieux considéré. À titre d’exemple
(figure 2)
, la compa-
raison de trois troubles anxieux a montré, en ce qui concerne le
trouble anxieux généralisé, des anomalies neuro-anatomiques,
comme une augmentation du volume de l’amygdale, et probable-
ment aussi du cortex préfrontal ainsi que des régions temporales.
Pour le trouble obsessionnel compulsif, il a été observé une aug-
mentation de l’activité au niveau du cortex orbitofrontal, du cor-
tex cingulaire antérieur et du noyau caudé ; enfin, pour la phobie
sociale, il a été décrit une augmentation de l’activité amygdalienne
et cingulaire et une diminution de celle des ganglions de la base.
Supports neurobiologiques
Dans la compréhension de la nature de l’anxiété, les travaux de
J. Gray sur l’anxiété et les circuits cérébraux qui l’engendrent
ont permis de poser les premières bases solides de réflexion.
Partant du fait que l’alcool, les barbituriques et les benzodiazé-
pines, produits différents par leurs propriétés et leurs formules
chimiques, pouvaient tous soulager l’anxiété, J. Gray s’est pro-
La Lettre du Psychiatre - vol. II - n° 1 - janvier-février 2006
DOSSIER THÉMATIQUE
Mise au point
30
Figure 1. Le circuit de l’anxiété :
interconnexion entre les différentes
structures cérébrales impliquées
dans le traitement de l’information
des stimuli extérieurs et de la réponse
appropriée.
Cortex
sensoriel
primaire
Stimulus
sensoriel
Route courte
Caractéristiques
Stimulus émotionnel
Cortex
associatif
unimodal
Route
longue
Cortex
associatif
polymodal
Entrée de
l'information
Sortie de
l'information
Hippocampe
Contexte
Concept
Objet
Noyau
basal
accessoire
Réponses émotionnelles
Noyau
basal
parvi-
cellulaire
Noyau
central
Noyau latéral
Tronc cérébral Hypothalamus
Noyau basal
magnocellulaire
Noyau
médial
Figure 2. Neuro-anatomie fonctionnelle schématique et troubles anxieux.
Trouble anxieux
généralisé
Troubles
obsessionnels
compulsifs
Phobie sociale

posé d’étudier les effets de ces trois substances sur diverses
tâches comportementales chez le rat, et ainsi de dresser un por-
trait “comportemental” de l’anxiété. De plus, il a recherché des
régions cérébrales dont les lésions produiraient des effets com-
parables à ceux des anxiolytiques sur la réalisation de ces tâches
afin d’isoler les structures anatomiques en action. Ce projet a
conduit, en 1982, à ce qui a été appelé la “théorie neuronale de
l’anxiété”.
Cette théorie a permis de mettre en avant certains mécanismes,
et tout d’abord, à l’époque, le rôle central du GABA dans
l’anxiété, partant du postulat que les benzodiazépines ont un
effet direct sur le GABA, facilitant son action inhibitrice, et
rendant ainsi difficile l’excitation du neurone postsynaptique
par le glutamate. L’hypothèse du complexe macromoléculaire
GABA/BZD en a découlé (4, 5). Plus tard est venue la recon-
naissance, en fait, d’une action indirecte du GABA sur l’anxiété
avec la mise en jeu des systèmes aminergiques, notamment séro-
toninergique, histaminergique et noradrénergique, probablement
comme voie finale d’action anxiolytique.
Pendant longtemps, il a résulté de ces observations une sorte
de “pensée unique”, essentiellement – pour ne pas dire totale-
ment – axée sur les anxiolytiques de la classe des benzodia-
zépines (BZD) ; ce n’est que depuis une quinzaine d’années
qu’il apparaît de manière assez consensuelle que l’“anxiété”
pourrait rendre compte d’un dysfonctionnement des systèmes
5-HT, allant dans le sens d’un excès en sérotonine. Il est ainsi
étonnant de constater que, globalement, jusqu’à ces dernières
années, aucun progrès majeur dans la compréhension et la
prise en charge de ces troubles n’a été vraiment réalisé.
D’ailleurs, si nous considérons l’arsenal chimiothérapeutique,
il est facile de constater qu’il n’y a pas de classification des
anxiolytiques, contrairement à ce qui existe pour les antidé-
presseurs, par exemple, et nous nous référons à une liste OMS.
De plus, il est intéressant de noter que les substances réperto-
riées sur cette liste sont très hétérogènes, aussi bien par leur(s)
impact(s) sur des cibles neurobiologiques différentes que par
leurs mécanismes d’action variés. Enfin, l’indication dans les
troubles anxieux de molécules dites antidépressives, dont le
mécanisme d’action pourrait aller à l’encontre des hypothèses
émises sur l’anxiété (augmentation des transmissions séroto-
ninergiques et noradrénergiques, par exemple), n’a pas faci-
lité non plus une vision claire de la prise en charge de ces
patients.
C’est justement dans la prise en compte de l’apparition de nou-
velles cibles neurobiologiques
(tableau)
que des espoirs concer-
nant la synthèse de nouvelles molécules anxiolytiques sont appa-
rus, comme une alternative ou non aux BZD.
Plusieurs grands axes sont à l’heure actuelle en plein développe-
ment :
✓complexe macromoléculaire GABA/BZD et modulations
allostériques : les modulateurs des sous-unités (extracellulaires) ;
✓systèmes GABAergiques : molécules intervenant à différents
niveaux du métabolisme ;
✓excitabilité neuronale : acides aminés excitateurs et inhibiteurs
et canaux calciques.
COMPLEXE MACROMOLÉCULAIRE GABA/BZD
ET MODULATIONS ALLOSTÉRIQUES :
LES MODULATEURS DES SOUS-UNITÉS (EXTRACELLULAIRES)
L’acide gamma-aminobutyrique (GABA) est un neurotransmet-
teur inhibiteur du système nerveux central présentant, selon les
auteurs, de 40 à 60 % des synapses. Le GABA exerce ses effets
par l’intermédiaire de trois types de récepteurs :
– le récepteur GABA-A, le plus connu ;
– le récepteur GABA-B, qui fait partie des récepteurs métabo-
tropiques ; couplé aux protéines G, présent sous forme de
dimères, il est subdivisé en sous-types B1 (α,β,γ,δ) et B2 ;
– le récepteur GABA-C (ρ1, ρ2, ρ3), présent dans la rétine et
l’hippocampe.
Au niveau présynaptique, la stimulation du récepteur GABA-B
entraîne une inhibition de la libération du neurotransmetteur. Il
semble jouer un rôle dans les états dépressifs, la mémoire, la dou-
leur et l’anesthésie.
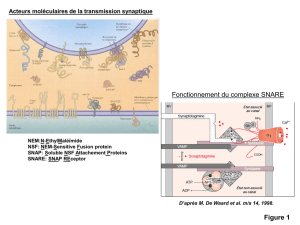
Le récepteur GABA-A fait partie de la superfamille des récep-
teurs ionotropiques. C’est un complexe macromoléculaire trans-
membranaire formé de plusieurs sous-unités. Le récepteur
GABA-A forme un hétéropentamère délimitant un canal per-
méable préférentiellement aux ions chlore
(figure 3)
.
Outre les sites de fixation primaire au GABA, ce complexe
macromoléculaire comporte d’autres sites secondaires pour des
molécules modulatrices de l’effet du GABA (benzodiazépines,
barbituriques, convulsivants, alcool, etc.)
[figure 4]
. Ces sites
entraînent l’une des deux régulations allostériques, l’une au
niveau extracellulaire (cas présent), l’autre au niveau des
canaux ioniques. En ce qui concerne les modulateurs extracel-
lulaires susceptibles de changer l’efficacité du GABA, ils n’ont
pas pour autant la finalité de générer une action anxiolytique
avérée, comme on a pu le croire un certain temps avec les
neurostéroïdes, par exemple. De plus, ces substances peuvent
favoriser l’effet du GABA, mais sont sans effet en l’absence de
ce dernier.
La Lettre du Psychiatre - vol. II - n° 1 - janvier-février 2006
Mise au point
31
Tableau. Anxiété : multiples interactions neurobiologiques.
Molécules complexe macromol. Molécules à tropisme
BZD/GABA aminergique
– Benzodiazépiniques et apparentés – Sérotonine
– Neurostéroïdes – Noradrénaline
– Histamine
– Dopamine
Molécules peptidergiques et al. Molécules et neuromédiateurs
– CCK-B – GABA
– Antagoniste CRF (axe HHA) – Glutamate
– Neurotensine (axe HHA) – N-méthyl-D-aspartate
– Substance P – Glycine
– Neurotrophines (NK1) – Adénosine
– Neuropeptide Y
– Vasopressine/ocytocine Molécules : autres
– Galaline – Cytokines
– Facteurs neurotrophiques

C’est à partir de ce complexe macromoléculaire et de ces sites
qu’un grand nombre de molécules souhaiteraient “revendiquer”
l’efficacité des benzodiazépines en tant qu’anxiolytiques, sans en
avoir les effets secondaires. Toutefois, il faut bien noter que la
modification allostérique de ce complexe n’est pas non plus ini-
tiatrice d’une dynamique anxiolytique.
En revanche, c’est probablement à partir des isoformes de ces sous-
unités que l’avancée de la recherche est la plus probante, sur le plan
à la fois des connaissances neurobiologiques et de la détermination
de médicaments anxiolytiques futurs (6). Ainsi, à l’heure actuelle,
on a identifié près de 19 isoformes, dont 17 ont été clonés (7). On
distingue actuellement 6 sous-types de sous-unités alpha (α),
4 sous-types de sous-unités bêta (β), 3 sous-types de sous-unités
gamma (γ) et un sous-type de sous-unités delta (δ), epsilon (ε), pi
(π) et 3 rhô (ρ). Cela entraîne non seulement une grande hétérogé-
néité de structure, mais aussi une hétérogénéité pharmacologique,
dont les conséquences sont encore mal connues. À partir de ligands
spécifiques d’une sous-unité ou de combinaisons de sous-unités, il
est possible de déterminer l’activité de la molécule, sans retrouver
systématiquement les cinq propriétés à la fois bénéfiques et délé-
tères que possèdent les benzodiazépines. Il est toutefois nécessaire
de confirmer si les propriétés de ces nouveaux composés, retrou-
vées chez l’animal, se confirment chez l’homme (8).
Modulateurs allostériques extracellulaires du GABA-R :
sous-unités
Les agonistes à effet allostérique modulent la sensibilité du récep-
teur GABA-A à l’effet du GABA. Ils peuvent favoriser ou réduire
l’effet du GABA mais, jusqu’à présent, n’ont été retenus comme
médicaments que ceux qui le favorisaient : ce sont principalement
les benzodiazépines et les barbituriques. On distingue deux types
de récepteurs des benzodiazépines (BZD) selon que leur activation
par des agonistes favorise l’ouverture du canal Cl-(quasi-totalité
des BZD utilisées en thérapeutique) ou tente de s’y opposer (effet
agoniste inverse). Des antagonistes peuvent inhiber l’effet des ago-
nistes : un neuropeptide d’origine endogène, appelé diazepam bin-
ding inhibitor, s’oppose à la fixation des BZD et à leurs effets. Des
substances d’origine exogène, comme le flumazénil, et peut-être à
un moindre degré la caféine, sont aussi des antagonistes.
Globalement, aujourd’hui, on commence à déterminer, in vitro
ou chez l’animal, l’activité de ces sous-unités, seules ou en com-
binaison. Ainsi, il a pu être mis en évidence le fait que :
– la sous-unité α1, qui est la plus répandue au niveau du système
nerveux central (SNC), pourrait médier seule un effet sédatif par
l’action d’un modulateur positif ; elle pourrait également être à
l’origine des amnésies antérogrades (9), comme possiblement la
sous-unité α5 (10) ;
– la sous-unité α2 pourrait médier seule un effet anxiolytique, ainsi
qu’en combinaison α2 α3 (11). Cette sous-unité pourrait égale-
ment rendre compte d’un effet myorelaxant, l’un ou l’autre par l’ac-
tion d’un modulateur positif. Par exemple, plusieurs molécules dites
“modulateurs positifs de sous-unités spécifiques”, en cours de déve-
loppement, présenteraient une action anxiolytique, sans effet séda-
tif ; c’est le cas du PTAO23 (α2 α 3), du L-838417 (α2 α3 α5)
et du SL-651,438 (α2 α3 et agoniste partiel α1 α5) (12) ;
– la sous-unité α 3, moins bien connue, pourrait médier seule, par
l’action d’un modulateur négatif, un effet anxiogène. Par ailleurs,
un modulateur positif comme le PT003 (α3) pourrait entraîner
chez l’animal une diminution de la consommation alcoolique et
du stress induit et provoquer une hypothermie ; il ne serait pas
sédatif. L’ELB139, un modulateur positif (α3), a montré chez
l’animal un effet anxiolytique ainsi qu’une absence de tolérance
et de dépendance ; il est actuellement en phase II chez l’homme.
La Lettre du Psychiatre - vol. II - n° 1 - janvier-février 2006
DOSSIER THÉMATIQUE
Mise au point
32
Figure 3. Le complexe macromoléculaire GABA/BZD. Conformations
spéculatives.
Canal
chlore
Complexe récepteur/canal ionique
α
γ
βα
β
Figure 4. Le complexe GABA/BZD et ses sites modulateurs extracellulaires.
Récepteurs
histamine
Récepteurs
stéroïdes
pregnanolone
corticoïdes
Site
barbiturique
Site
picrotoxine
Site
anesthésique
alphaxolone
Récepteurs
benzodiazépine
et ses sous-unités
Cl –
Zn
Ca 2+
α β
γ
Site
éthanol
Récepteur
GABA-A
Systèmes neurobiologiques (NAD, 5-HT, DA, etc.)
+
+
+
+
+
+−
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%