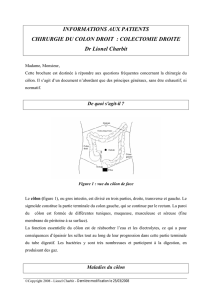
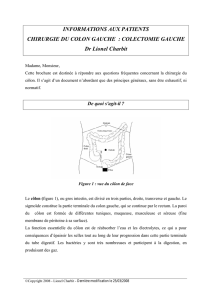
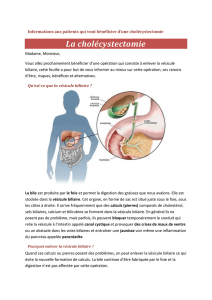
141
La Lettre du Cancérologue - Volume XII - no4 - juillet-août 2003
D
epuis la première cholécystectomie par laparoscopie
réalisée en 1986, la faisabilité de cette voie d’abord
a été documentée pour toutes les interventions de
chirurgie digestive. À côté de l’épargne pariétale, les avantages
attendus dans la période postopératoire immédiate par rapport à
la laparotomie sont la diminution de la douleur et de la durée de
l’iléus, et donc la réduction de la durée d’hospitalisation et de ces-
sation des activités pour l’opéré.
Le développement de la laparoscopie en chirurgie oncologique
digestive a été initialement freiné par les publications, en 1995,
de greffes tumorales sur les sites de trocart après colectomie pour
cancer. La fréquence de ces greffes tumorales variait de 1,5 à
4,5 %. Ces mêmes greffes tumorales, de survenue précoce
–quelques semaines à quelques mois postopératoires –, ont aussi
été rapportées après des cholécystectomies faites pour lithiase
biliaire, le cancer de vésicule étant une découverte de l’examen
anatomopathologique.
La récente publication d’une étude prospective randomisée com-
parant les résultats oncologiques de la colectomie pour cancer par
laparotomie et par laparoscopie, concluant à la supériorité de
cette dernière, relance un débat toujours actif et justifie cette mise
au point sur les indications de la laparoscopie dans le traitement
du cancer colorectal (1).
LES GREFFES TUMORALES SUR LES SITES DE TROCART
Elles ont été décrites pour de nombreuses localisations tumorales
(côlon, rectum, vésicule, pancréas, foie, vessie, ovaire), y com-
pris pour des lésions classées in situ ou pT1. Pour le cancer du
côlon, dans les études les plus récentes, la fréquence de ces greffes
tumorales est nulle dans plusieurs séries monocentriques (ce qui
correspond à notre expérience) et inférieure à 0,9 % dans des
registres multicentriques (2). Contrairement à la crainte initiale,
cette fréquence, à stade TNM équivalent, n’est pas supérieure
à celle qui était observée en laparotomie. La diminution de fré-
quence de cette complication, constatée ces dernières années,
peut s’expliquer par une meilleure maîtrise par les chirurgiens
de la colectomie par laparoscopie et par le respect de précautions
techniques dont l’efficacité a été suggérée par des études expé-
rimentales (fixité des trocarts, absence de manipulation de la
tumeur, extraction de la pièce dans un sac plastique, protection
des berges de l’incision d’extraction de la pièce, exsufflation du
pneumopéritoine trocarts en place…). Des études expérimen-
tales ont aussi étudié l’influence du type de gaz utilisé pour le
pneumopéritoine sur la croissance tumorale, la dissémination
tumorale intra- et extrapéritonéale et la fréquence des greffes
tumorales sur les sites de trocart. Seul l’hélium, non utilisé en
clinique, permettrait de diminuer la dissémination tumorale et
le risque de greffe tumorale sur ces sites. Actuellement, pour le
cancer du côlon, le risque de greffe tumorale sur les trajets de
trocart n’est plus une contre-indication à la laparoscopie.
En revanche, nous récusons la laparoscopie au profit de la lapa-
rotomie devant toute suspicion de tumeur de la vésicule. En effet,
en cas de cancer de la vésicule de découverte fortuite sur l’exa-
men anatomopathologique après cholécystectomie pour lithiase
biliaire, la fréquence de ces greffes tumorales varie dans la litté-
rature de 10 à 17 %. Il a aussi été montré qu’en cas de cholécys-
tectomie par laparoscopie, des cellules épithéliales biliaires
étaient retrouvées dans le péritoine.
IMMUNITÉ ET LAPAROSCOPIE
Une moindre dépression immunitaire postopératoire est un avan-
tage avancé pour défendre la laparoscopie en chirurgie oncolo-
gique. De multiples études expérimentales (chez la souris, la sou-
ris athymique, le cochon…) et cliniques ont été réalisées, pour
la cholécystectomie et la colectomie. Tout, ou à peu près tout, a
été étudié : les populations lymphocytaires, les interleukines, le
TNFα, l’α1-CTI, la fonction kupférienne… Deux études datant
de 1995 illustrent les difficultés d’interprétation des résultats
expérimentaux. L’étude de Jones, où des cellules tumorales
étaient injectées dans le péritoine de souris, montre que la crois-
sance tumorale est plus importante après réalisation d’un pneu-
mopéritoine qu’après une laparotomie : il ne faudrait donc pas
faire de laparoscopie pour cancer ! L’étude d’Allendorf, où des
cellules tumorales étaient injectées en sous-cutané chez la sou-
ris, montre que la croissance tumorale est plus importante après
laparotomie qu’après réalisation d’un pneumopéritoine : il ne fau-
drait donc pas faire de laparotomie pour cancer ! Il faut noter que
ce dernier résultat n’est pas retrouvé si l’expérience est effectuée
avec des souris athymiques. Cependant, plusieurs études pros-
pectives randomisées réalisées chez l’homme, depuis 1997, mon-
trent une meilleure préservation de l’immunité cellulaire par la
Peut-on réséquer un cancer colorectal par laparoscopie ?
Minimal invasive surgery for colorectal cancer
●
T. Perniceni*
* Département médico-chirurgical de pathologie digestive, Institut mutualiste
Montsouris, 42, bd Jourdan, 75014 Paris.
MISE AU POINT

MISE AU POINT
142
La Lettre du Cancérologue - Volume XII - no4 - juillet-août 2003
laparoscopie. Pour certains auteurs, cela expliquerait les meilleurs
résultats postopératoires immédiats obtenus par la laparoscopie
dans la prise en charge des cancers du côlon (3).
LA PERTE DE LA PALPATION EN LAPAROSCOPIE
Un inconvénient de la laparoscopie est la perte de la palpation.
Cela rend difficile la localisation d’une tumeur n’envahissant pas
la séreuse. Il est donc très important de localiser la lésion à résé-
quer, en préopératoire (opacification colique, cliché au cours de
la coloscopie diagnostique, mise en place d’un clip radio-opaque
en coloscopie) ou en peropératoire (coloscopie ou rectoscopie).
L’endoscopie peropératoire est particulièrement utile en cas de
tumeur du rectum non accessible au toucher rectal pour s’assu-
rer que la marge de sécurité sous-tumorale est respectée. L’explo-
ration du foie reste tout à fait possible grâce à l’échographie per-
opératoire, mais la perte de la palpation peut faire méconnaître
des lésions infracentimétriques sous-capsulaires dans un foie
d’échostructure remaniée.
LAPAROSCOPIE ET CANCER DU CÔLON
Les règles de la chirurgie oncologique habituellement observées
en laparotomie, bien que de faible niveau de preuve, sont trans-
posables en laparoscopie : absence de manipulation tumorale,
ligature première des vaisseaux à l’origine, résection en bloc (4).
Une lymphadénectomie de qualité permettant de correctement
classer un opéré pN0 est techniquement réalisable.
Toutes les colectomies sont faisables ; les pertes sanguines per-
opératoires sont moins importantes qu’avec la laparotomie. Le
taux de conversion, certes variable avec l’expérience de l’opéra-
teur, est inférieur à 5 % dans les équipes expérimentées. La mor-
talité opératoire, nulle dans beaucoup de séries, n’est pas diffé-
rente de celle observée en laparotomie. Il en est de même pour la
morbidité, en particulier le taux de fistules anastomotiques. Toutes
les études sont concordantes pour indiquer une augmentation de
la durée opératoire, notamment au début de l’expérience.
La qualité oncologique de la résection, jugée sur le nombre de
ganglions trouvés dans la lymphadénectomie (cela dépendant
aussi du pathologiste) et la longueur de la marge de sécurité, est
identique, voire supérieure, en laparoscopie. Dans notre expé-
rience, le nombre moyen de ganglions examinés est de 25 après
laparotomie et de 22 après laparoscopie, et nous n’avons jamais
observé de recoupe envahie.
Mais le critère de jugement le plus important reste la survie. On
ne dispose actuellement que d’une seule étude prospective ran-
domisée comparant les résultats à long terme (41 mois en
moyenne) de la colectomie pour cancer par laparoscopie et lapa-
rotomie (1). Dans ce travail en analyse multivariée, la laparo-
scopie améliore significativement la survie actuarielle spéci-
fique, notamment pour les opérés de stade III. Cette étude a été
violemment critiquée, les critiques portant principalement sur la
méthodologie (choix d’une étude d’équivalence, insuffisance du
nombre d’opérés inclus), sur les résultats inhabituels du bras
laparotomie, avec un taux de récidives locorégionales de 14 %,
et sur la différence de traitement postopératoire entre les deux
bras (plus de chimiothérapie adjuvante après laparoscopie).
Au congrès du Collège américain des chirurgiens colorectaux,
en 2002, beaucoup de travaux présentés concluaient en faveur
de la laparoscopie (avantages postopératoires immédiats,
moindre morbidité, mêmes résultats carcinologiques à 5 ans,
moindre immunodépression). Sous réserve des résultats des
autres études prospectives randomisées actuellement en cours,
on peut conclure que la laparoscopie peut être utilisée pour l’exé-
rèse d’un cancer du côlon, mais à une condition majeure : le chi-
rurgien doit être formé à la laparoscopie et à la chirurgie colique
par laparoscopie. Beaucoup d’auteurs sont d’accord pour esti-
mer que le préalable est la réalisation d’une trentaine de colec-
tomies pour lésion bénigne.
LAPAROSCOPIE ET CANCER DU RECTUM
Sur le plan chirurgical, l’amélioration des résultats oncologiques
passe par la réalisation d’une exérèse extrafasciale du méso-
rectum, cette exérèse devant être totale pour les tumeurs de
l’ampoule rectale basse (5). Pour ces mêmes tumeurs, la marge
de sécurité sous-tumorale peut être réduite à 2 cm ; les indi-
cations d’amputation abdominopérinéale ont donc diminué. La
réalisation d’un réservoir colique en cas d’anastomose colo-sus-
anale ou colo-anale a permis d’améliorer les résultats fonction-
nels pour les opérés. Enfin, la dissection extrafasciale du méso-
rectum permet une meilleure préservation des nerfs pelviens et
donc une diminution des séquelles urinaires et sexuelles (6).
Tous ces acquis sont-ils transposables à la laparoscopie ?
Il est possible techniquement de faire, en laparoscopie, une dis-
section extrafasciale du mésorectum. En cas de tumeur de
l’ampoule rectale basse, la dissection est faite jusqu’au plancher
pelvien, avec une exérèse totale du mésorectum. Dans notre
expérience, la marge circonférentielle, élément pronostique
majeur, a toujours été respectée ; il en est de même de la marge
sous-tumorale. Il est probable que l’excellente vision du champ
opératoire procurée par la laparoscopie facilite la dissection pel-
vienne, notamment en cas de pelvis étroit, et le respect des nerfs
pelviens. La réalisation d’anastomoses colo-sus-anale ou colo-
anale avec réservoir est possible comme par laparotomie. Mais
la proctectomie par laparoscopie reste une intervention plus dif-
ficile que la colectomie, avec un taux de conversion de 15 à 20 %.
La radiothérapie préopératoire ne gêne pas la laparoscopie.
Peu de résultats à long terme sont disponibles. Il semble cependant
que la laparoscopie ne dégrade pas les résultats oncologiques. Dans
une étude comparative historique menée dans notre département,
la survie spécifique des opérés par laparoscopie est meilleure, en
analyse multivariée, que celle des opérés par laparotomie (7).
CONCLUSION
Au total, pour l’exérèse par laparoscopie d’un cancer colique ou
rectal :
– la qualité oncologique de l’exérèse est respectée ;
– les résultats carcinologiques à long terme devraient être iden-
tiques à ceux de la laparotomie ;
– une meilleure qualité des suites opératoires immédiates (non

143
La Lettre du Cancérologue - Volume XII - no4 - juillet-août 2003
3. Braga M, Vignali A, Gianotti L et al. Laparoscopic versus open colorectal
surgery. A randomized trial on short-term outcome. Ann Surg 2002 ; 6 : 759-67.
4. Kohler L, Eypasch E, Paul A, Troidl H. Myths in management of colorectal
malignancy. Br J Surg 1997 ; 84 : 248-51.
5. Lehander Martling A, Holm T, Rutqvist LE, Moran BJ, Heald RJ, Ceder-
mark B. Effect of a surgical training programme on outcome of rectal cancer
in the county of Stockholm. Lancet 2000 ; 356 : 93-6.
6. Lindsey I, Guy RJ, Warren BF, Mortensen NJ. Anatomy of Denonvilliers’
fascia and pelvic nerves, impotence, and implications for the colorectal sur-
geon. Br J Surg 2000 ; 87 : 1288-99.
7. Imperato M, Gayet B, Perniceni T et al. Chirurgie du cancer du rectum : les
résultats des proctectomies par cœlioscopie et laparotomie ne sont pas équiva-
lents. Gastroenterol Clin Biol 2002 ; 26 : A49.
encore formellement démontrée) pourrait permettre de diminuer
le délai entre chirurgie et traitement adjuvant ;
– mais l’apprentissage de la technique, notamment de la proc-
tectomie, est difficile.
■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Lacy AM, Garcia-Valdecasas JC, Delgado S et al. Laparoscopic-assisted
colectomy versus open colectomy for treatment of non metastatic colon cancer :
a randomised trial. Lancet 2002 ; 359 : 2224-9.
2. Silecchia G, Perrotta N, Giraudo G et al. Abdominal wall recurrences after
colorectal resection for cancer. Dis Colon rectum 2002 ; 45 : 1172-7.
Erratum diaporama ASCO 2003
Une erreur s’est glissée dans le commentaire de la diapositive n° 16, il fallait lire :
“des résultats plus intéressant en réponse et en survie sans progression”,
à la dernière ligne du commentaire.
1
/
3
100%