Les troubles du rythme chez l’enfant A

Médecine
& enfance
A
COMME ADÉNOSINE
TRIPHOSPHATE (STRIADYNE®)
Le diagnostic de l’origine d’une tachy-
cardie supraventriculaire (TSV) de l’en-
fant repose sur l’identification des auri-
culogrammes et sur l’analyse de la liai-
son entre les ondes P et les complexes
QRS
(figure 1)
. Lorsque l’ECG montre au-
tant d’ondes P que de QRS, ou quand on
ne voit pas les ondes P, il faut recourir à
des manœuvres vagomimétiques, qui
créent un bloc auriculo-ventriculaire
(BAV) transitoire. En milieu hospitalier,
le test à l’ATP (Striadyne
®
) permet
d’identifier l’origine des TSV. L’injection
se fait par voie intraveineuse, en bolus
(sur une bonne voie d’abord, avec une
purge de sérum physiologique), à la do-
se de 0,5 à 2 mg/kg, répétable, l’esto-
mac ayant été vidé ou chez l’enfant à
jeun ; l’injection d’ATP est déconseillée
en cas de bronchospasme. Chez le nou-
veau-né, la méthode non invasive la
plus efficace pour stimuler le tonus va-
gal est l’application d’une vessie de gla-
ce sur le visage durant 10 secondes ;
chez l’enfant plus grand, on a recours
au réflexe oculo-cardiaque.
En bloquant l’influx électrique dans le
nœud auriculo-ventriculaire, les ma-
nœuvres vagales entraînent l’arrêt bru-
tal des TSV par réentrées dans 80 % des
cas (ou bien n’ont aucun effet) : c’est la
loi du tout ou rien. En cas de tachycar-
die d’origine atriale, les manœuvres va-
gales permettent de démasquer les
ondes P en créant un BAV transitoire
(fi-
gure 2)
, mais elles n’interrompent pas le
trouble du rythme.
B
COMME BLOC AURICULO-
VENTRICULAIRE COMPLET (BAVC)
Le BAVC est une anomalie rare, le plus
souvent diagnostiquée sur une brady-
cardie. L’ECG montre une dissociation
complète entre le rythme sinusal nor-
mal et un rythme d’échappement ven-
triculaire plus lent
(figure 3)
, ce qui per-
met de faire le diagnostic différentiel
avec des extrasystoles atriales bloquées.
Quand le bloc est diagnostiqué avant ou
peu après la naissance, la recherche
d’anticorps maternels anti-SSA et/ou
anti-SSB est presque toujours positive,
indiquant l’origine immunologique du
bloc. La cause des blocs diagnostiqués
plus tard dans l’enfance reste le plus
Les troubles du rythme
chez l’enfant
E. Villain, cardiologie pédiatrique, hôpital
Necker-Enfants Malades, Paris
ABÉCÉDAIRE
septembre 2008
page 287
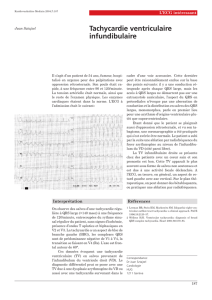
Figure 1
Schéma pour le diagnostic des TSV
Identification des auriculogrammes P’
(spontanés ou manœuvres vagales)
P > QRS
Réentrée
atriale
– flutter
– tachy-
systolie
– tachycardie
atriale
chaotique
P = QRS
Réentrée
jonctionnelle
– voie
accessoire
– réentrée
intranodale
P < QRS
(ou
dissociation)
Tachycardie
hissienne
Figure 2
TSV du nouveau-né et du nourrisson,
ECG en 25 mm/s
Tracés du haut et du milieu : tachycardie à
QRS fins, à 280/mn avec des ondes P difficiles
à identifier. L’injection de Striadyne®« casse »
la tachycardie avec retour en rythme sinusal. Il
s’agit donc d’une TSV par réentrée
jonctionnelle. On voit ensuite l’aspect avec PR
court et onde delta, caractéristique d’un
syndrome de Wolff-Parkinson-White.
Tracé du bas (D II) : l’injection de Striadyne®
crée un BAV transitoire, qui laisse apparaître
les ondes P’ d’une tachycardie atriale
ectopique (P’ négatives en DII).
115939 287-292 22/09/08 16:18 Page 287

souvent inconnue, et on pense mainte-
nant qu’il ne s’agit pas de blocs authen-
tiquement « congénitaux »
[1]
.
Le seul traitement efficace d’un BAVC
est l’implantation d’un stimulateur car-
diaque. Des symptômes ou une fréquen-
ce ventriculaire basse sont les princi-
pales indications de stimulation. Les
nourrissons dont la fréquence ventricu-
laire est inférieure à 50/mn et les en-
fants dont la fréquence moyenne diurne
(sur un enregistrement des vingt-quatre
heures) est inférieure à 50/mn repré-
sentent un groupe à haut risque de syn-
cope ou de mort subite et doivent être
stimulés. Les sondes de stimulation sont
introduites par voie chirurgicale chez
les jeunes enfants, puis par voie veineu-
se au-delà de 10-15 kg. Les progrès de
la stimulation permettent maintenant
aux enfants ayant un BAVC de mener
une vie normale.
C
COMME CATÉCHOLERGIQUE
La TV catécholergique est une affection
rare, à rechercher chez des enfants qui
font des syncopes lors d’efforts ou
d’émotions et dont l’ECG et l’échocar-
diographie sont normaux. Les syncopes
sont dues à des troubles du rythme ven-
triculaire polymorphes. L’épreuve d’ef-
fort permet de faire le diagnostic, car el-
le reproduit le trouble du rythme de fa-
çon stéréotypée : accélération sinusale,
puis extrasystoles ventriculaires poly-
morphes, volontiers bidirectionnelles
(fi-
gure 4)
, enfin TV bidirectionnelle ou po-
lymorphe. Un caractère familial est re-
trouvé chez environ 30 % des patients.
Ces formes sont liées à des mutations
dans des gènes contrôlant les mouve-
ments calciques intracellulaires. L’évo-
lution sans traitement est la mort subi-
te, mais les bêtabloquants préviennent
les troubles du rythme efficacement
chez la plupart des enfants ; dans
d’autres cas, l’implantation d’un défi-
brillateur est nécessaire
[3]
.
D
COMME DÉFAILLANCE SINUSALE
Très rare chez l’enfant, elle s’observe
surtout chez les enfants opérés de car-
diopathies congénitales. Rappelons que
certains syndromes de QT long se révè-
lent par une bradycardie sinusale néo-
natale
[4]
.
E
COMME EXTRASYSTOLES
La constatation d’extrasystoles, atriales
ou ventriculaires, est rare chez le nou-
veau-né et le nourrisson ; elles sont ha-
bituellement bénignes et régressent
dans les premiers mois de vie
[5]
. Chez
l’enfant sans anomalie cardiaque, on
observe parfois des extrasystoles ventri-
culaires, qui sont en règle bénignes lors-
qu’elles sont toutes identiques (mono-
morphes), isolées et qu’elles disparais-
sent à l’effort. Dans tous les cas, une
consultation spécialisée avec échocar-
diographie doit être demandée.
F
COMME FLUTTER ATRIAL
Le flutter atrial sur cœur sain est un
trouble du rythme observé in utero et
chez les nouveau-nés. L’ECG montre
une tachycardie régulière, avec des
ondes P en dents de scie sans retour à la
ligne isoélectrique
(figure 5)
. Chez le nou-
veau-né, la distinction entre un flutter
et un foyer ectopique est parfois diffici-
le. La conduction vers les ventricules se
fait habituellement en 2/1, ce qui ex-
plique que la tolérance clinique soit ini-
tialement bonne. La méthode élective
de réduction de ce trouble rythmique
est la stimulation atriale transœsopha-
gienne. Quand on ne dispose pas du
matériel nécessaire, on fait un choc
électrique externe si l’hémodynamique
est compromise ; si le flutter est bien to-
léré, on peut prescrire de l’amiodarone
per os, souvent efficace en quelques
jours pour réduire les flutters néonatals.
En principe, une fois réduit, ce trouble
du rythme ne récidive pas.
G
COMME GÈNES
Les progrès de la génétique moléculaire
ont permis de rattacher certaines patho-
logies rythmiques à des mutations dans
les gènes codant pour les canaux io-
niques myocardiques, ouvrant ainsi la
voie à la notion de « canalopathies ».
Dans ce groupe s’intègrent en particu-
lier le syndrome de Brugada (mutation
dans le gène SCN5A), très rare chez
l’enfant mais pouvant entraîner des
morts subites, en particulier lors d’un
épisode fébrile
[6]
, ainsi que les syn-
dromes de QT long ou court et les TV
catécholergiques. Des anomalies géné-
tiques sont également à rechercher en
cas de troubles de la conduction auricu-
lo-ventriculaire
[7]
.
H
COMME HISSIEN
Les tachycardies hissiennes sont les plus
rares des TSV, mais les plus graves, car
elles sont souvent méconnues et réfrac-
taires au traitement. Elles surviennent
chez des nourrissons au cœur sain, et
également dans les suites immédiates
de la chirurgie cardiaque. Elles sont
liées à l’activité d’un foyer ectopique si-
tué dans le faisceau de His. L’ECG
montre une tachycardie entre 150 et
300/mn, à QRS fins, avec dissociation
auriculo-ventriculaire (plus de com-
plexes QRS que d’ondes P) et complexes
de capture
(figure 6)
. L’amiodarone est le
traitement le plus efficace des tachycar-
dies hissiennes ; il est souvent nécessai-
re de débuter le traitement par une dose
importante (1 g/m
2
per os).
Médecine
& enfance
septembre 2008
page 288
Figure 3
BAVC congénital
Dissociation auriculo-ventriculaire complète
avec une fréquence sinusale normale (120/mn)
plus rapide que le rythme d’échappement
ventriculaire (60/mn).
Figure 4
TV catécholergique
Extrasystoles ventriculaires bidirectionnelles
apparaissant lors d’une épreuve d’effort.
115939 287-292 18/09/08 23:43 Page 288

I
COMME INTERDIT
L’injection intraveineuse de drogues an-
ti-arythmiques peut s’avérer dangereu-
se chez les jeunes enfants (risque de
BAV, de collapsus). C’est le cas en parti-
culier de l’amiodarone et des calciums-
bloquants, dont nous proscrivons l’utili-
sation par voie intraveineuse. Rappe-
lons ici que la digoxine est contre-indi-
quée chez tous les patients ayant une
pré-excitation ventriculaire, quel que
soit leur âge.
J
COMME JOULES
Certains troubles du rythme sévères
avec collapsus doivent être réduits par
choc électrique externe synchronisé.
Chez le jeune enfant, l’énergie délivrée
ne doit pas dépasser 3 J/kg.
K
COMME KALIÉMIE
Penser à la contrôler en cas de torsades
de pointes ou de troubles de la repolari-
sation :
hypokaliémie : aplatissement de T et
apparition d’une onde U, allongement
de QT ;
hyperkaliémie : élargissement de
QRS, ondes T pointues.
L
COMME LUCIANI-WENCKEBACH
Se définit sur l’ECG par un allongement
progressif de l’espace PR précédant une
onde P bloquée. Des périodes de Lucia-
ni-Wenckebach peuvent s’observer chez
l’enfant normal, lors d’une stimulation
vagale transitoire, en particulier la nuit.
Par contre, la constatation d’un bloc du
deuxième degré durable chez un enfant
est pathologique, et nécessite une
consultation en milieu spécialisé, en rai-
son du risque d’évolution vers un bloc
complet
[8]
.
M
COMME MYOCARDIOPATHIE
RYTHMIQUE
N’importe quel trouble du rythme chro-
nique peut évoluer vers une défaillance
cardiaque avec altération de la fonction
myocardique par épuisement des ré-
serves énergétiques du cœur. Devant
une myocardiopathie en apparence pri-
mitive de l’enfant, il faut donc toujours
rechercher un trouble du rythme sous-
jacent. Le diagnostic est particulière-
ment difficile en cas de foyer ectopique
situé dans la partie haute de l’oreillette
droite ou bien à proximité de la veine
pulmonaire supérieure droite, car l’auri-
culogramme a alors la morphologie et
l’axe d’une onde P normale, si bien que
ces tachycardies ressemblent à des ta-
chycardies sinusales. L’attention doit
être attirée par un espace PR un peu
long ; les manœuvres vagales sont très
utiles pour démasquer les ondes P en
créant un BAV transitoire
[9]
.
N
COMME NORMAL
Chez le nouveau-né, la fréquence car-
diaque maximale est d’environ 170 à
190/mn et la fréquence minimale ne
descend pas au-dessous de 80/mn.
Chez le nourrisson, la fréquence maxi-
male lors des cris peut atteindre 220
voire 240/mn, et la fréquence minimale
reste au-dessus de 60/mn ; l’écart entre
le jour et la nuit apparaît à partir du
troisième mois. Chez l’enfant plus
grand, la limite supérieure du rythme
sinusal à l’activité est d’environ 180 à
200/mn et les fréquences minimales
peuvent s’abaisser jusqu’à 45/mn. Au
repos, l’accentuation de la variabilité si-
nusale est banale au-delà de huit à dix
ans, mais les pauses sinusales nocturnes
n’excèdent en règle pas 1800 ms.
O
COMME OREILLETTE
Dans les formes typiques, les tachycar-
dies naissant dans les oreillettes [10] se
caractérisent sur l’ECG par des ondes P’
dont l’axe n’est pas sinusal, avec plus
d’ondes P’ que de QRS, spontanément
ou sous l’effet des manœuvres vagales
(figure 2)
.
Les tachycardies atriales ectopiques ou ta-
chysystolies
(TSA) sont liées à l’automa-
ticité anormale d’un foyer ectopique au-
riculaire. Ces tachycardies sont difficiles
à traiter et sont insensibles à la cardio-
version, comme à la stimulation rapide ;
l’amiodarone, les agents IC (flécaïnide),
seuls ou associés aux bêtabloquants,
sont les drogues les plus efficaces. Le
pronostic des TSA de l’enfant est très bon
quand le trouble du rythme débute avant
l’âge de deux ou trois ans, car le foyer ec-
topique finit en règle par disparaître
avec la croissance
[9-11]
. Chez le grand
enfant par contre, une ablation par ra-
diofréquence est nécessaire pour suppri-
mer le foyer anormal d’activation atriale.
La tachycardie atriale chaotique
s’observe
surtout chez des nourrissons de moins
de six mois. Le diagnostic est facile à
faire en examinant l’ECG, qui montre
une activité atriale polymorphe (au
moins trois morphologies d’ondes P) ra-
Médecine
& enfance
septembre 2008
page 289
Figure 5
Flutter néonatal
A : flutter atrial, bloqué 2/1 vers les
ventricules ;
B : ondes de flutter démasquées par l’injection
de Striadyne®;
C : stimulation atriale en « rafale », par voie
œsophagienne, permettant de casser le
trouble du rythme.
Figure 6
Tachycardie hissienne postopératoire.
La fréquence ventriculaire est à presque
150/mn, avec des QRS fins, et on voit des
ondes P dissociées et dont la fréquence est
plus lente (environ 70/mn).
115939 287-292 18/09/08 23:43 Page 289

pide et irrégulière ; la conduction auri-
culo-ventriculaire est variable et des as-
pects de bloc de branche sont égale-
ment observés
(figure 7)
. Les formes ra-
pides doivent être traitées médicale-
ment, et l’amiodarone et/ou les bêta-
bloquants sont les traitements les plus
efficaces. La guérison définitive permet
le sevrage thérapeutique dans les pre-
mières années de vie.
P
COMME PALPITATIONS
Chez les enfants, les palpitations sont
un motif fréquent de consultation. Un
bilan cardiologique doit être réalisé
mais le plus souvent l’ECG et l’enregis-
trement holter sont normaux. Dans cer-
tains cas, il peut être utile de remettre à
l’enfant un appareil permettant la trans-
mission par téléphone-fax des ECG en-
registrés au cours des symptômes. Dans
la pratique, il est rare de faire ainsi le
diagnostic d’un authentique trouble du
rythme, mais cet examen a le mérite de
rassurer la famille et l’enfant.
Q
COMME QT LONG
Le syndrome de QT long (QTL) congéni-
tal se caractérise par un allongement de
l’espace QT sur l’ECG de surface. L’espa-
ce QT varie avec la fréquence cardiaque
et doit être « corrigé » en fonction de la
fréquence instantanée grâce à la formu-
le de Bazett : QT corrigé (QTc) =
QT mesuré (ms)
intervalle RR précédent (ms)
chez l’enfant et l’adolescent, on parle de
QT long lorsque QTc est supérieur à
440 msec
(figure 8)
.
Les syndromes de QTL congénital sont
la conséquence de mutations dans les
gènes codant pour les canaux ioniques
responsables du potentiel d’action cel-
lulaire. A chaque gène correspond une
affection différente. QTL 1 et 2, les plus
fréquents, sont dus à des mutations
dans les gènes qui codent les canaux po-
tassiques ; beaucoup plus rare, QTL3 est
dû à des mutations dans le gène codant
le canal sodique rapide.
Les troubles du rythme ventriculaires
(torsades de pointe) sont la complica-
tion la plus sévère des syndromes de
QTL
(figure 8)
. Ils sont responsables de
syncopes, d’effort le plus souvent
(noyades), et d’une mortalité très élevée
en l’absence de traitement. Les syn-
dromes du QTL peuvent également en-
traîner des troubles fonctionnels de la
conduction auriculo-ventriculaire
(formes néonatales sévères de QTL2)
[4]
.
Le traitement de fond des syndromes de
QTL repose sur les bêtabloquants à vie
[12]
. Il faut également remettre à l’en-
fant et à sa famille une liste de tous les
médicaments susceptibles d’allonger
l’espace QT, qui doivent être exclus. Les
formes sévères (QTL 3) et les patients
homozygotes (Jervell et Lange-Nielsen)
justifient souvent la pose d’un défibril-
lateur automatique implantable.
R
COMME RÉENTRÉE
Les tachycardies jonctionnelles par ré-
entrée sont les plus fréquentes des TSV
du nourrisson
[13]
. Durant les accès de
tachycardie, la voie normale nodo-his-
sienne est empruntée des oreillettes
vers les ventricules, et la voie accessoire
(faisceau de Kent) est empruntée dans
le sens rétrograde
(figure 9)
. Après inter-
ruption du circuit grâce aux manœuvres
vagales, le traitement préventif des réci-
dives repose sur l’amiodarone jusqu’à
l’âge de un an
[14]
.
Chez l’enfant plus grand, on observe
également des réentrées à l’intérieur de
la jonction auriculo-ventriculaire : ce
sont les réentrées intranodales (maladie
de Bouveret).
S
COMME SYNCOPE
Les malaises et syncopes représentent
une cause fréquente de consultation en
pédiatrie, et la majorité d’entre eux sont
bénins. Un ECG doit être fait systémati-
quement chez tout enfant ayant eu un
malaise. Chez le nourrisson, les ma-
laises sont en règle la conséquence
d’une bradycardie brutale, d’origine ré-
flexe vagale, souvent déclenchée par un
stimulus douloureux (reflux gastro-
œsophagien). Chez les enfants plus
grands, les circonstances de survenue
Médecine
& enfance
septembre 2008
page 290
Figure 7
Tachycardie atriale chaotique.
L’activité atriale est irrégulière, polymorphe
et instable. On voit également des ondes P
bloquées et des QRS larges, par bloc de
branche fonctionnel.
Figure 8
Syndrome de QT long congénital.
Tracé du haut : QT long avec aspect en double
bosse de ST, laisse penser qu’il s’agit d’un QTL
2.
Tracé du bas : torsade de pointes.
Figure 9
Schéma d’un mécanisme de réentrée
entre la voie normale de conduction,
empruntée des oreillettes vers les
ventricules, et un faisceau de Kent,
emprunté des ventricules vers les
oreillettes, activées de façon rétrograde.
115939 287-292 18/09/08 23:43 Page 290

des spasmes du sanglot ou des malaises
sont assez stéréotypées et permettent
d’identifier l’origine vagale bénigne des
symptômes.
Tout malaise ou syncope survenant dans
un contexte d’effort
(natation surtout)
mérite une exploration plus poussée.
Une consultation spécialisée avec ECG,
échocardiographie, enregistrement hol-
ter, voire épreuve d’effort, permettra
d’identifier les causes de syncope et de
mort subite que sont certaines malfor-
mations et myocardiopathies, le bloc
complet, le syndrome de Wolff-Parkin-
son-White et les « canalopathies »
[15]
.
T
COMME TRAITEMENT
L’amiodarone
est l’anti-arythmique pé-
diatrique de référence en France.
L’amiodarone doit être administrée per
os, à la dose de charge de 500 mg/m
2
/j
durant 8 à 10 jours, relayée par une do-
se d’entretien de 250 mg/m
2
/j. Les ef-
fets secondaires indésirables sont rares
chez l’enfant. Il s’agit essentiellement
de l’intolérance cutanée avec photosen-
sibilisation. Les dysthyroïdies ne sont le
plus souvent que biologiques, mais tout
traitement par l’amiodarone doit être
accompagné d’une surveillance systé-
matique des fonctions thyroïdiennes.
Le propranolol
(Avlocardyl
®
) reste enco-
re aujourd’hui le bêtabloquant de réfé-
rence le plus connu et le plus utilisé, à la
dose de 3 mg/kg/j en 3 ou 4 prises.
Le nadolol
(Corgard
®
) est le bêtablo-
quant d’effet retard le plus puissant, et
c’est donc le médicament électif des
syndromes du QTL et des TV catécho-
lergiques. Chez l’enfant, on le prescrit à
la dose de 50 mg/m
2
/j en 2 prises. L’ef-
fet du traitement doit être vérifié par
des épreuves d’effort et par des enregis-
trements holter.
U
COMME UNITÉS
Toujours vérifier la vitesse de déroule-
ment et l’étalonnage d’un ECG, de mê-
me que le positionnement des élec-
trodes ! Rappelons qu’un ECG normal
est enregistré en 25 mm/s (un « petit »
carré = 200 ms) et en 1 cm = 1 mV.
V
COMME VENTRICULAIRE
Une tachycardie ventriculaire (TV) mo-
nomorphe est une tachycardie à QRS
larges, différents des complexes sinu-
saux, et identiques entre eux ; l’existen-
ce d’une dissociation auriculo-ventricu-
laire et de complexes de fusion et de
capture permet d’affirmer le diagnostic
de TV
(figure 10)
. Ce diagnostic doit tou-
jours faire rechercher une cause sous-ja-
cente, mais les TV sur cœur normal
constituent le sous-groupe le plus im-
portant des TV de l’enfant
[16]
.
Les TV « idiopathiques » du nourrisson
s’observent entre trois et vingt-quatre
mois. La fréquence ventriculaire est ha-
bituellement comprise entre 160 et
350/mn, et, du fait de son caractère in-
cessant, ce type de TV conduit souvent
à une myocardiopathie dilatée sévère.
La cardioversion est inefficace, mais
l’amiodarone per os permet en règle de
restaurer un rythme sinusal stable, et la
tachycardie disparaît habituellement
avant l’âge de quatre ans, ce qui autori-
se le sevrage thérapeutique
[17]
.
W
COMME WOLFF-PARKINSON-WHITE
Chez certains enfants ayant une voie ac-
cessoire (faisceau de Kent), l’influx
électrique d’origine sinusale circule si-
multanément dans la voie nodo-hissien-
ne et dans la voie accessoire (dépour-
vue du frein vagal), si bien qu’un des
ventricules est activé avant l’autre : il en
résulte un aspect de pré-excitation avec
PR court et onde delta sur l’ECG
(figure 2)
définissant une syndrome de Wolff-Par-
kinson-White. La gravité de ce syndro-
me tient au risque de syncope, voire de
mort subite, auquel sont exposés les pa-
tients
[18]
. Ces accidents sont la consé-
quence de la conduction très rapide
vers les ventricules d’un trouble du
rythme atrial, habituellement une fibril-
lation, à travers une voie accessoire très
perméable, court-circuitant le nœud au-
riculo-ventriculaire. L’ECG montre alors
une tachycardie irrégulière, avec des
QRS plus ou moins larges (plus ou
moins « pré-excités ») car l’influx en pro-
venance des oreillettes est conduit à la
fois par la voie normale et par la voie
accessoire
(figure 11)
. Les formes avec
collapsus sont traitées par choc élec-
trique externe. L’utilisation d’agents dé-
primant la conduction (adénosine,
ATP) est contre-indiquée, car ces
drogues favorisent la transmission ex-
clusive des influx atriaux par la voie ac-
cessoire et induisent donc une accéléra-
tion de la fréquence ventriculaire. C’est
également en raison de ce risque que la
digoxine est contre-indiquée chez tous
les patients ayant une pré-excitation
ventriculaire.
Aucune méthode ne permet avec certi-
tude de prédire quels sont les enfants à
risque de syncope, mais l’étude électro-
physiologique permet de tester la vulné-
rabilité atriale et la perméabilité antéro-
grade de la voie accessoire
[19]
. On
conseille de réaliser cet examen vers
l’âge de dix ans, et une ablation par ra-
Médecine
& enfance
septembre 2008
page 291
Figure 10
Tachycardie ventriculaire monomorphe
chez un nourrisson
Tachycardie à QRS larges, avec dissociation
entre les ondes P (cf DII) et les QRS.
Figure 11
ECG enregistré après une syncope chez
un enfant de douze ans
On voit des complexes QRS de morphologies
variables, irréguliers. Le RR le plus court
correspond à une fréquence ventriculaire
> 300/mn = fibrillation atriale conduite par
voie antérograde à la fois par la voie nodo-
hissienne et par un faisceau de Kent.
115939 287-292 18/09/08 23:43 Page 291
 6
6
1
/
6
100%