D Pronostic des petites tumeurs du sein 1

≤ 1 cm
1,1-3 cm
> 3 cm
Taux de rechute
0,30
0,20
0,10
0
Années
0 1 2 3 4 5 6 7 8 9 10 11 12
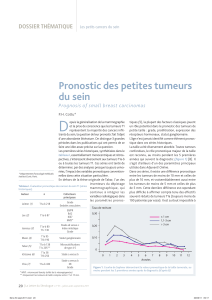
Figure 1. Courbe de Saphner démontrant la valeur pronostique de la taille tumorale, au
moins pendant les 5 premières années après le diagnostic (d’après 8).
264 | La Lettre du Cancérologue • Vol. XXI - n° 5 - mai 2012
MISE AU POINT
Pronostic des petites tumeurs
du sein1
Prognosis of small breast carcinomas
P.H. Cottu*
1 © La Lettre du Sénologue 2011;
53(3):20-4.
* Département d’oncologie médicale,
institut Curie, Paris.
D
epuis la généralisation de la mammographie
et la prise de conscience que les tumeurs T1
représentent la majorité des cancers infi l-
trants du sein, la question de leur pronostic fait
l’objet d’une abondante littérature. On distingue
3 grandes périodes dans les publications qui ont
permis de se faire une idée assez précise sur la
question.
Les premières séries historiques, synthétisées dans le
tableau I, essentiellement monocentriques et rétros-
pectives, s’intéressent diversement aux tumeurs
T1a-b ou à toutes les tumeurs T1. Ces séries ont tenté
de déterminer, par des analyses presque toujours
univariées, l’impact des variables pronostiques
conventionnelles dans cette situation particulière.
En dehors de la thèse originale de Tabar, l’un des
inventeurs du dépistage mammographique, qui
continue à intégrer les variables radiologiques
dans les paramètres pronostiques (5), la plupart des
facteurs classiques jouent un rôle potentiel dans le
pronostic des tumeurs de petite taille : grade, prolifé-
ration, expression des récepteurs hormonaux, statut
ganglionnaire.
L’âge n’est jamais identifi é comme élément pronos-
tique dans ces séries historiques.
La taille a été diversement abordée. Toutes tumeurs
confondues, le rôle pronostique majeur de la taille
est reconnu, au moins pendant les 5 premières
années qui suivent le diagnostic (figure 1) [8].
Il s’agit d’ailleurs d’un des paramètres principaux
utilisés dans Adjuvant! Online.
Tableau I. Évaluation pronostique des cancers du sein T1
(séries historiques).
Auteur n Cofacteurs principaux
Leitner
(1)
T1a-b 218 Grade
Emboles vasculaires
Lee
(2)
T1a-b 87
ER/PR
Bcl2
Ki67
MVD*
Joensuu
(3)
T1a-b 80
T1c 130
Stade ab versus c
Index mitotique
Grade
Mann
(4)
T1a 95
T1b 196 Statut ganglionnaire
Tabar
(5)
T1a-b 138
T1c 205**
Microcalcifi cations
de type 4-5
Ichizawa
(6)
T1a 38
T1b 256 Stade a versus b
Chia
(7)
T1a-b 430
Stade a versus b
ER
Grade
* MVD :
microvessel density
(refl et de la néoangiogenèse).
** Uniquement les tumeurs de taille comprise entre 11 et 15 mm.

0 5 10 15
Temps écoulé depuis le diagnostic (années)
0,3
0,4
0,2
0,1
0
Décès par autre cause, taille ≥ 6 mm
Décès par autre cause, taille ≤ 5 mm
Décès par cancer, taille ≥ 6 mm
Décès par cancer, taille ≤ 5 mm
Figure 2. Données de survies spécifi que et globale en fonction de la
taille tumorale (10).
0 12 24 36 48 60
0,90
0,92
0,94
0,96
0,98
1,00
Survie cumulée
Temps écoulé depuis le diagnostic (mois)
T1a
T1b
Figure 3. Survie à 5 ans des patientes ayant une tumeur T1a et T1b dans
l’étude de la NCDB (d’après 9).
La Lettre du Cancérologue • Vol. XXI - n° 5 - mai 2012 | 265
Points forts
»Le pronostic des cancers du sein de moins de 1cm est globalement excellent.
»Les paramètres pronostiques conventionnels et moléculaires s’appliquent à cette population.
»Il existe des sous-groupes (HER2, triple-négatif) de moins bon pronostic.
Mots-clés
Cancer du sein
1cm
HER2
Triple-négatif
Highlights
»
Prognosis of less than 1cm
breast cancer is excellent.
»
Conventional and molecular
prognostic features do apply to
small breast cancer.
»
HER2 positive and triple
negative small breast cancer
have also a poorer prognosis.
Keywords
Breast cancer
1cm
HER2
Triple negative
Dans ces séries, il existe une différence pronostique
entre les tumeurs de moins de 10 mm et celles de
plus de 10 mm, et vraisemblablement aussi entre
les tumeurs de moins de 5 mm et celles de plus
de 5 mm. Cette dernière différence est cependant
plus diffi cile à affi rmer compte tenu des effectifs
souvent réduits de tumeurs T1a (toujours moins de
100 patientes par essai). Il est surtout impossible à
ce stade de dégager lequel ou lesquels des facteurs
pronostiques classiques discriminent potentielle-
ment T1a et T1b.
La deuxième période (2006-2007) correspond aux
publications des grandes séries épidémiologiques
nord-américaines, issues de 3 sources majeures :
la National Cancer Database (9) ; le SEER (10) et les
données issues des essais du NSBAP (11).
Ces dernières proviennent des études B6, B13, B14,
B19, B20, B21 (détails accessibles sur http://www.
nsabp.pitt.edu/NSABP_Protocols.asp) ayant inclus
au total 11 195 patientes, toutes pN0. Parmi ces
patientes, 1 259 avaient une tumeur T1ab (11,2 %).
Les principaux facteurs défavorables sur la survie
à long terme ont été l’âge, le stade a-b versus c,
l’absence de traitement adjuvant et la présence
d’emboles lymphatiques.
Les données du SEER (10) ont permis de décrire
une cohorte de 51 246 patientes atteintes de
tumeur T1a ou T1b, N0, M0. Le modèle de Cox
a permis d’isoler comme facteurs pronostiques
indépendants l’âge inférieur à 50 ans, le grade III,
l’absence d’expression des récepteurs hormonaux
et une sous-évaluation ganglionnaire conduisant
vraisemblablement à un traitement adjuvant insuf-
fisant. Alors que, curieusement, il semble exister des
causes compétitives de décès différentes entre les
populations T1a et T1b, il est impossible de mettre
en évidence une différence de probabilité de décès
spécifique (figure 2).
Enfin, la série de la National Cancer Data Base
(NCDB) a repris les données de 123 212 patientes
atteintes d’une tumeur T1a ou T1b, N0, M0. Un tel
effectif a permis de réaliser une analyse multivariée
qui isole des facteurs pronostiques indépendants
exactement superposables aux données du SEER :
la taille (a versus b), l’âge (± de 50 ans), le grade
(I-II versus III) et l’absence de traitement adjuvant
adéquat.
Plus précisément, la différence absolue de survie à
5 ans entre T1a et T1b est de 1,3 %, mais cette diffé-
rence est signifi cative avec un HR = 1,15 (1,05-1,26 ;
p = 0,04) [fi gure 3].
L’ensemble de cette caractérisation pronostique
peut être résumé sous la forme d’un nomogramme
utilisable en pratique clinique pour la décision théra-
peutique (10), au moins pour les patientes dont la
tumeur ne surexprime pas HER2 (fi gure 4, p. 266).

0 10 20 30 40 50 60 70 80 90 100
Points
1
2
3
Négatif
Positif
Négatif
Positif
0
4-9
> 9 1-3
2 4 6 8
1 3 5 7 9
Grade
Statut RE
Statut RP
Ganglions lymphatiques
prélevés
Taille
Âge 70 80 90 100 110
60 40 30 20
Total des points
Prévision de survie
sans maladie à 5 ans
Prévision de survie
sans maladie à 10 ans
0 20 40 60 90 100 140 180 200 280
0,95 0,9 0,95 0,9 0,75
0,95 0,9 0,95 0,8 0,7 0,6 0,5
20 40 60 70 80 90 100
0,9 0,7 0,3 0,1
0,9 0,7 0,3 0,1
Âge
Prévision de survie
à 5 ans
Prévision de survie
à 10 ans
AB
Figure 4. Nomogramme pronostique des tumeurs T1 N0, sans tenir compte de l’expression de HER2 (d’après 10).
266 | La Lettre du Cancérologue • Vol. XXI - n° 5 - mai 2012
Pronostic des petites tumeurs du sein
MISE AU POINT
Cas particuliers
Tumeurs surexprimant HER2
La troisième période est celle de l’évaluation du rôle
pronostique de la surexpression de HER2 dans les
tumeurs T1N0. Elle vient en grande partie balayer
et simplifi er la vision du pronostic de ces petites
tumeurs.
Huit études rétrospectives et monocentriques ont
été publiées sur cette question et sont résumées
dans le tableau II.
Le principe général de ces études a consisté à
comparer le pronostic des tumeurs T1 surexprimant
HER2 à celui des autres tumeurs T1. Pour 6 auteurs,
la surexpression de HER2 est un facteur pronostique
défavorable en analyse multivariée, le plus souvent
au côté du grade et/ou de la prolifération, et parfois
de l’âge et de l’absence d’expression des récepteurs
hormonaux. Toutes ces études ont été menées chez
des patientes n’ayant pas reçu de trastuzumab en
situation adjuvante.
Il est à noter que l’apport pronostique de HER2 ne
peut pas être différencié en fonction de la taille
tumorale, si bien que la question particulièrement
épineuse du pronostic des tumeurs T1a surexprimant
HER2 n’est pas spécifi quement abordée.
Tableau II. Pronostic des cancers du sein T1a-b surexprimant HER2.
Auteur Population n Facteurs principaux*
Joensuu
(12)
T1a
T1b
T1c
49
264
539
HER2*
Grade*
Colleoni
(13)
T1a
T1b
76
325
HER2
KI67 élevé*
RH–
Chia
(14)
T1a-b
T1c
T2
T3-4
21
96
85
3
HER2*
Tovey
(15)
T1a-b-c
T2
214
88
HER2*
Âge*
Grade*
Taille*
Chimiothérapie*
Ananthakrishnan
(16)
T1a-b
T1c+
35
87
HER2
Grade
Curigliano
(17)
T1a
T1b
85
65
HER2*
Gonzalez-Angulo
(18)
T1a
T1b
43
55
HER2*
RH–*
Âge*
Park
(19)
T1a-b 370 HER2*
Statut
triple-négatif*
* Facteur pronostique indépendant en analyse multivariée.

0
20
40
60
80
100
0
20
40
60
80
100
0
20
40
60
80
100
0
0 2 4 6 8 10 12
0 2 4 6 8 10 12
0 2 4 6 8 10 12
0 2 4 6 8 10 12
0 2 4 6 8 10 12
0 2 4 6 8 10 12
0 2 4 6 8 10 12
0 2 4 6 8 10 12
20
40
60
80
100
0
20
40
60
80
100
0
20
40
60
80
100
0
20
40
60
80
100
0
20
40
60
80
100
Années de suivi Années de suivi
Années de suivi Années de suivi
Années de suivi Années de suivi
Années de suivi Années de suivi
p = 0,04
p = 0,44
p = 0,006
p = 0,001
p = 0,01
p = 0,02
p = 0,32
p = 0,0011-10 mm
1-10 mm
1-10 mm
1-10 mm 11-20 mm
11-20 mm
11-20 mm
11-20 mm
grade 1 (n = 129)
grade 2-3 (n = 110)
grade 1 (n = 125)
grade 2-3 (n = 260)
RE+ (n = 143)
RE– (n = 57)
RE+ (n = 306)
RE– (n = 105)
HER2 (IHC) – (n = 171)
HER2 (IHC) + (n = 23)
HER2 (IHC) – (n = 329)
HER2 (IHC) + (n = 46)
HER2 (CISH) – (n = 167)
HER2 (CISH) + (n = 17)
HER2 (CISH) – (n = 316)
HER2 (CISH) + (n = 46)
Survie sans récidive Survie sans récidive Survie sans récidive Survie sans récidive
Figure 5. Survie sans maladie par grade histologique, statut RE et statut HER2 (mesuré
par immunohistochimie et FISH). Colonne de gauche : tumeurs de 1 à 10 mm. Colonne
de droite : tumeurs de 11 à 20 mm.
00
0,2
0,4
0,6
0,9
1
Temps écoulé depuis le diagnostic (mois)
12 24 36 48 6012 24 36 48 60
0,2
0,4
0,6
0,9
1RH+
HER2+
Tumeur
triple-négative
Tumeur
négative
AB
Tumeur
positive
Figure 6. Pronostic à long terme des tumeurs T1 N0 selon le sous-type moléculaire apprécié en immunohistochimie,
avant le trastuzumab adjuvant (d’après 18).
La Lettre du Cancérologue • Vol. XXI - n° 5 - mai 2012 | 267
MISE AU POINT
Par ailleurs, l’énigmatique relation entre HER2 et le
récepteur aux estrogènes ne semble pas davantage
résolue : l’expression des récepteurs hormonaux joue
un rôle pronostique protecteur uniquement dans
l’étude du groupe canadien (14) et semble au mieux
neutre dans les autres études où le facteur HER2 est
le plus puissant.
Ainsi, dans le travail de Joensuu (11), le pronostic
des tumeurs pT1N0M0, bien défini par le grade
histologique et la taille tumorale, est davantage
infl uencé par le statut HER2 que par la réceptivité
au récepteur estrogène (RE) [fi gure 5].
La fi gure 6 résume la vision pronostique défavorable
des tumeurs T1 N0 surexprimant HER2. Cet aspect a
également été souligné dans un éditorial du Journal
of Clinical Oncology (20) qui accompagnait la publi-
cation des données de Milan (17) et du MDACC (18).
Malheureusement, il n’existe actuellement aucun
nomogramme intégrant HER2 dans l’évaluation
pronostique. De même Adjuvant ! Online n’intègre
pas HER2 dans sa version actuelle (V8).
Tumeurs basales triple-négatives
Ces grandes séries de données de la littérature ont
été renouvelées depuis l’identifi cation du sous-type
moléculaire dit “basal”, confondu de manière approxi-
mative mais pragmatique avec les cancers “triple-
négatifs” (TN), qui n’expriment ni ER, ni PR, ni HER2.
La représentation de ce sous-type ne semble pas
moins fréquente pour les tumeurs T1, soit entre 10
et 15 % (21), à l’exception peut-être des tumeurs
diagnostiquées grâce au dépistage mammogra-
phique (22).
La série du MD Anderson (18) montrait déjà
le mauvais pronostic des cancers TN T1a-b N0
(fi gure 6). Plusieurs autres séries rétrospectives

0
20
40
60
80
100
0 2 4 6 8 10
93 %
78 %
Années
70 gènes de bon pronostic (n = 85)
70 gènes de mauvais pronostic (n = 55)
HR = 3,45 (1,04-11,5)
p = 0,04
Taux de survie sans récidive à distance (DDFS) 3
Figure 7. Apport de la signature d’Amsterdam dans l’évaluation pronostique des tumeurs
T1ab N0 (d’après 28).
268 | La Lettre du Cancérologue • Vol. XXI - n° 5 - mai 2012
Pronostic des petites tumeurs du sein
MISE AU POINT
décrivant le pronostic des tumeurs T1, soit de type
basal, soit TN, ont été publiées récemment.
À long terme, il a ainsi été montré que le pronostic
des tumeurs basales de stade T1 est identique à celui
des tumeurs de plus haut stade, malgré un peu moins
de rechutes précoces (23, 24).
En analysant plus spécifi quement les tumeurs T1 N0,
un travail mené sur une série de 110 patientes (6 %
T1a, 21 % T1b, et 73 % T1c) a montré que le risque
de rechute était 6,57 fois plus élevé (IC
95
: 2,34-
18,49) pour les tumeurs TN que pour les tumeurs
ER+, quels que soient l’âge et les traitements adju-
vants reçus (25).
La série la plus importante est coréenne et relate
10 ans de suivi de 370 patientes atteintes d’un cancer
du sein TN de stade T1a-b N0 (19). L’analyse multi-
variée par un modèle de Cox a révélé que le statut
triple-négatif et la surexpression de HER2 étaient
des facteurs pronostiques péjoratifs indépendants.
Le risque relatif de rechute à distance est de 5,1
(p = 0,026) pour le groupe TN et de 8,8 (p = 0,003)
pour le groupe HER2. La cohorte de patientes avec
une tumeur T1a était trop limitée pour pouvoir tirer
une conclusion spécifi que.
Avec les tumeurs TN, nous nous retrouvons actuelle-
ment dans la même situation que pour les tumeurs
HER2+ avant l’ère du trastuzumab : pronostic défa-
vorable quelle que soit la taille, avec un reste d’incer-
titude pour les tumeurs T1a N0 (26).
Apport des signatures moléculaires
Les signatures moléculaires, qui ont permis l’iden-
tifi cation des sous-types moléculaires de cancer
du sein, ont également été utilisées dans un but
d’évaluation pronostique.
Une des signatures les mieux validées est la signa-
ture d’Amsterdam, dite “70 gènes” (27), dont la
valeur pronostique a été testée sur une population
de 964 patientes atteintes de tumeurs T1. Après un
suivi médian de 7,1 ans, les auteurs montrent que la
signature “70 gènes” est un facteur pronostique indé-
pendant de survie spécifi que et de survie sans métas-
tases pour l’ensemble de la population T1. Surtout,
la signature appliquée spécifi quement aux tumeurs
T1a-b prédit de manière indépendante et puissante
la survie sans métastases à 10 ans (HR = 3,45 ; IC95 :
1,04-11,50 ; p = 0,04) [28] (fi gure 7).
Conclusion
Le pronostic des petites tumeurs infi ltrantes du sein,
même s’il est globalement excellent, n’en est pas
moins hétérogène, et mérite d’être attentivement
évalué au cas par cas. Il est notable que les facteurs
biologiques conventionnels et ceux plus récents,
comme les signatures moléculaires, s’appliquent avec
la même importance que pour les tumeurs de plus de
1 cm, et doivent être systématiquement appréciés. ■
1. Leitner SP, Swern AS, Weinberger D, Duncan LJ, Hutter
RV. Predictors of recurrence for patients with small (one
centimeter or less) localized breast cancer (T1a,b N0 M0).
Cancer 1995;76:2266-74.
2. Lee AK, Loda M, Mackarem G et al. Lymph node nega-
tive invasive breast carcinoma 1 centimeter or less in size
(T1a,bNOMO): clinicopathologic features and outcome.
Cancer 1997;79:761-71.
3. Joensuu H, Pylkkanen L, Toikkanen S. Late mortality
from pT1N0M0 breast carcinoma. Cancer 1999;85:
2183-9.
4. Mann GB, Port ER, Rizza C, Tan LK, Borgen PI, Van Zee KJ.
Six-year follow-up of patients with microinvasive, T1a, and
T1b breast carcinoma. Ann Surg Oncol 1999;6:591-8.
5. Tabar L, Chen HH, Duffy SW et al. A novel method for
prediction of long-term outcome of women with T1a, T1b,
and 10-14 mm invasive breast cancers: a prospective study.
Lancet 2000;355:429-33.
6. Ichizawa N, Fukutomi T, Iwamoto E, Akashi-Tanaka S.
Long-term results of T1a, T1b and T1c invasive breast
carcinomas in Japanese women: validation of the UICC T1
subgroup classifi cation. Jpn J Clin Oncol 2002;32:108-9.
7. Chia SK, Speers CH, Bryce CJ, Hayes MM, Olivotto IA.
Ten-year outcomes in a population-based cohort of node-
negative, lymphatic, and vascular invasion-negative early
breast cancers without adjuvant systemic therapies. J Clin
Oncol 2004;22:1630-7.
Références bibliographiques
Retrouvez l’intégralité
des références bibliographiques
sur www.edimark.fr
 6
6
1
/
6
100%