Visualisation de l`activité et de l`expression de récepteurs nucléaires

Visualisation de l’activité et de l’expression de récepteurs
nucléaires grâce à différentes méthodologies
Sandra Alves Francisco Supervision: Grégory Segala, PhD, Unige
Les récepteurs nucléaires sont des protéines se trouvant dans les cellules et capables de
transmettre des signaux hormonaux spécifiques en agissant sur la régulation de l'expression
de gènes cibles.
Ces récepteurs sont d’importants facteurs de transcription qui sont activés après avoir lié un
ligand spécifique (hormone). Ensuite, ils se rendent dans le noyau, où ils se lient à l’ADN et
contrôlent positivement ou négativement l’expression des gènes cibles.
Ajouter un numéro de figure, un titre et une légende
Dans mon projet, j’ai travaillé avec le récepteur des œstrogènes (ERα) et le récepteur des
glucocorticoïdes (GR).
Les œstrogènes, dont le plus important est l’œstradiol (17β-estradiol ou E2), sont des
hormones stéroïdes qui diffusent facilement à travers la membrane cellulaire, car ils sont
liposolubles, et n’agissent que dans des cellules qui portent des récepteurs des œstrogènes.
Ils sont responsables du fonctionnement du système reproducteur féminin et de l’apparition
des caractères sexuels secondaires féminins. Les cancers du sein qui expriment ERα sont
stimulés par cette hormone.
Les récepteurs d’hormones stéroïdes se trouvent déjà dans le cytosol avant de se lier à une
hormone. La fixation d’une hormone stéroïde à son récepteur cytoplasmique induit son
déplacement vers le noyau. Une fois dans ce dernier, le récepteur stéroïdien modifie la
transcription de gènes spécifiques en agissant sur le recrutement de la machinerie de
transcription. L’activation de la transcription permet à l’ARN polymérase de synthétiser l’ARN
messager codant pour des protéines spécifiques.

GR est le récepteur auquel le cortisol ainsi que d’autres glucocorticoïdes se lient,
fonctionnant selon le même mode qu’ER. Le cortisol est libéré en réponse au stress et au
faible taux de glucose dans le sang et a une activité anti-inflammatoire. La dexaméthasone
(Dex), que nous avons utilisée dans nos expériences, est une hormone glucocorticoïde de
synthèse. Elle a un effet anti-inflammatoire et immunosuppresseur (son activité est environ
40 fois celle du cortisol).
Dans le contexte de ce projet, différentes techniques ont été utilisées afin de visualiser
l’activité, l’expression et la localisation intracellulaire de ces protéines.
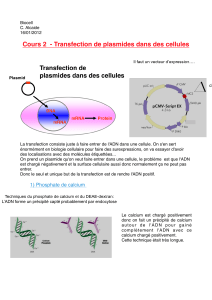
Transfection :
La transfection consiste à intégrer du matériel génétique exogène dans des cellules. Dans
notre cas, des cellules embryonnaires humaines de rein HEK293T, ont été transfectées avec
des plasmides, molécules d’ADN circulaire comportant des gènes cibles. Du
PolyEthylenImide (PEI), un agent de transfection condensant l’ADN des plasmides en des
particules chargées positivement et permettant leur introduction dans les cellules par
endocytose, est ajouté aux plasmides à tous les échantillons sauf celui spécifié ci-dessous.
Différentes transfections ont été effectuées selon l'expérience concernée. En effet, nous
avons effectué des transfections pour ensuite réaliser une expérience utilisant la microscopie
à fluorescence et le FACS, un essai luciférase et un western blot. Les conditions de
transfection pour chacune des expériences sont détaillées ci-après.
1) Pour visualiser la localisation intracellulaire de la protéine mais surtout pour étudier
l’efficacité de la transfection nous avons fait une microscopie à fluorescence puis un FACS
(Fluorescence-Activated Cell Sorting).
Nos cellules ont été transfectées avec un plasmide codant pour la GFP, une protéine
fluorescente, en même temps que des conditions contrôles :
1 : Plasmide vide
2 : Plasmide recombiné contenant le gène de la GFP
3 : Plasmide recombiné contenant le gène de la GFP mais pas de PEI
2) Afin d’étudier comment les récepteurs régulent l’expression des gènes cibles, un système
de luciférase assay a été utilisé.
Dans ce cas, l’expression de la firefly luciférase est sous contrôle d’un élément de réponse
du récepteur des œstrogènes(ERE) ou du récepteur des glucocorticoïdes (GRE), une courte
séquence nucléotidique présente dans l'ADN, au niveau des promoteurs des gènes, capable
d'être reconnue et liée par un facteur de transcription donné. Ces éléments dépendent donc
de l’activité d'ER ou de GR lors d’un traitement hormonal.
Des vecteurs permettant l'expression constitutive de la luciférase de Rénilla, sont utilisés en
combinaison avec les vecteurs de firefly luciférase pour co-transfecter nos cellules.
L'expression de la luciférase de Renilla fournit une valeur de contrôle interne à laquelle
l'expression du gène rapporteur expérimental de firefly luciférase peut être normalisée afin
de tenir compte de toutes les variations non spécifiques qu’il pourrait y avoir dans les

activités de la luciférase mesurées (variation d'efficacité de transfection, de toxicité, de
métabolisme cellulaire, de quantité de protéine,...).
Pour cette expérience nous utilisons plusieurs plasmides : Plasmide codant pour le récepteur
des œstrogènes (ERα) et plasmide codant pour la luciférase (promoteur sous contrôle de
l’élément de réponse d’œstrogène) (ERE-Luc) ou plasmide codant pour le récepteur de
glucocorticoïde (GR) et plasmide codant pour la luciférase (sous contrôle de l’élément de
réponse de glucocorticoïde) (GR-Luc), plasmide codant pour la Rénilla et des plasmides
vides qui ne codent pour aucun des éléments précités.
Nous avons préparé 6 puits pour chaque condition :
1 : pas de ERα + ERE-Luc (3 puits traités avec un milieu d’éthanol et 3 puits traités avec E2)
2 : ERα + ERE-Luc (3 puits traités avec un milieu d’éthanol et 3 puits traités avec E2)
3 : pas de GR + GR-Luc (3 puits traités avec un milieu d’éthanol et 3 puits traités avec Dex)
4 : GR + GR-Luc (3 puits traités avec un milieu d’éthanol et 3 puits traités avec Dex)
Les puits où il manque des plasmides codant pour ERα ou GR ont été tranfectés avec un
plasmide vide pour montrer que l'activité luciférase est bien dépendante de la présence des
récepteurs correspondants. Puis, la Rénilla a été mise dans tous les tubes pour pouvoir
effectuer la normalisation.
3) Pour étudier l’expression et la régulation de la quantité d’ERα et de GR, un Western Blot,
permettant l'identification et la quantification de protéines spécifiques, a été fait.
Pour cette expérience, nous avons préparé deux puits pour chaque condition :
1 : pas de ERα, plasmide vide (1 puit traité avec un milieu d’éthanol et 1 puit traité avec E2)
2 : ERα (1 puit traité avec un milieu d’éthanol et 1 puit traité avec E2)
3 : pas de GR, plasmide vide (1 puit traité avec un milieu d’éthanol et 1 puit traité avec Dex)
4 : GR (1 puit traité avec un milieu d’éthanol et 1 puit traité avec Dex)
Microscopie à fluorescence :
La microscopie en fluorescence est une technique utilisant un microscope à fluorescence qui
permet la visualisation de la fluorescence due à la GFP.

Résultats :
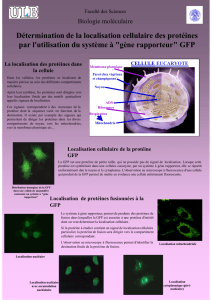
1) Photos des cellules au microscope à fluorescence
Fig. 1 Photos au microscope à fluorescence des cellules transfectées par un plasmide vide mais avec PEI, transfectées par un
plasmide codant pour la GFP et avec PEI ou transfectées par un plasmide codant pour la GFP mais sans PEI. Dans le premier
et le troisième échantillon, absence de fluorescence. Dans le deuxième, présence de cellules fluorescentes.
Discussion :
C’est une technique utile pour voir où la protéine est localisée mais surtout pour vérifier
l’efficacité qualitative de la transfection. Dans le premier échantillon, l’absence de GFP est la
cause de la non-fluorescence. Il y a eu transfection mais un plasmide vide ne peut pas coder
pour une protéine. Dans le deuxième, on voit que la transfection est efficace grâce à
l’expression de la GFP visible par la présence de cellules fluorescentes. Dans le troisième, Il
y avait le plasmide mais pas l’agent de transfection (PEI), donc la transfection était
impossible.
FACS (Fluorescence-Activated Cell Sorting) :
Le FACS ou cytométrie en flux est une technique qui fait défiler des cellules à grande vitesse
dans le faisceau d'un laser, ce qui permet de les compter et de les caractériser. C'est la
lumière réémise (par fluorescence) qui permet de trier la population cellulaire suivant
plusieurs critères comme par exemple l'intensité de fluorescence. Les cellules utilisées dans
cette expérience sont les mêmes que celles pour la microscopie à fluorescence.
Image
optique
Image
fluorescente

Résultats :
2) Histogrammes des cellules comptées par le FACS
A : plasmide vide/PEI B : plasmide GFP/pas de PEI C : plasmide GFP/PEI
Fig. 2 Histogrammes des cellules de l’expérience précédente comptées par le FACS en fonction de l’intensité de leur
fluorescence.
Dans ces histogrammes, nous voyons le nombre de cellules (counts) en fonction de
l'intensité de leur fluorescence (FL1-H). Seule la partie droite de l'histogramme est prise en
compte puisqu'elle correspond à une intensité de fluorescence spécifique de la GFP tandis
que la partie gauche correspond à l'autofluorescence des cellules. L’efficacité quantitative de
la transfection des plasmides dans les cellules est calculée : Panneau A, 0.24%, Panneau B,
0.32%, Panneau C, 72.72%. L’efficacité de la transfection du panneau C est élevée due à
des conditions optimales.
Luciferase assay :
Le système de luciférase reporter assay est souvent utilisé comme outil pour étudier
l’expression des gènes au niveau de la transcription. La luciférase est une classe d’enzymes
trouvées dans différentes espèces capables de les exprimer pour émettre de la lumière.
Une première bioluminescence résulte de l'oxydation de la luciférine en oxyluciférine qui est
catalysée par la luciférase firefly (luciole) et qui est accompagnée de l'émission de photons.
L’activité de la luciférase de Rénilla produit une deuxième bioluminescence selon le même
principe.
L’expression du gène reporteur de la luciférase sera mesurée afin de quantifier l’activité
transcriptionnelle du récepteur étudié.
Après avoir transfecté nos cellules, le traitement hormonal a été effectué. De l’éthanol a été
placé dans les puits contrôles, ce qui nous permettra de s'assurer que l’activité mesurée est
liée à un ligand et non au solvant qui le contient puisque les ligands sont solubilisés dans
l'éthanol. Puis, l’E2 et la Dex, ont été mises dans leurs puits respectifs à une concentration
saturante afin qu’il y ait un excès d’hormones par rapport aux récepteurs. Après activation de
ces derniers et que les différentes étapes de transcription, traduction et modifications post-
 6
6
 7
7
 8
8
 9
9
1
/
9
100%