L
es stratégies thérapeutiques complexes dans la prise
en charge des cancers bronchiques localisés sont l’un
des enjeux majeurs de la recherche clinique. La méta-
analyse parue dans le British Medical Journal en 1995 avait fait
poindre l’espoir que l’association chimiothérapie et chirurgie pour-
rait devenir un standard thérapeutique (1). La publication en 2004
de l’essai IALT, coordonné par T. Le Chevalier, en France, appor-
tait une preuve nouvelle du caractère judicieux de cette association,
même si le résultat brut pouvait paraître de faible ampleur, avec
une augmentation du taux de guérison de 4,1 % à 5 ans (2).
La publication par le New England Journal of Medicine, en juillet
2005, de l’essai intergroupe nord-américain apporte une contri-
bution supplémentaire à l’instauration de ce nouveau standard
thérapeutique.
Quatre grands groupes se sont associés pour le mener à bien : le
Cancer Trial Group du National Cancer Institute of Canada, le
CALGB1, l’ECOG1et le SWOG1.
Il s’agit d’un essai randomisé comparant, après une chirurgie
d’exérèse complète, une chimiothérapie adjuvante à la simple sur-
veillance. Les patients devaient présenter une tumeur localisée
de stade IB ou II. La chimiothérapie était une bithérapie compre-
nant cisplatine 50 mg/m2à J1 et J8 toutes les 4 semaines et vinorel-
bine 25 mg/m2, toutes les semaines et ce pour 4 cycles, sur une durée
de 12 semaines. Cinq cent trente-deux patients ont été enregistrés
et 482 randomisés, sur une période de 7 ans. La chimiothérapie
en position adjuvante se révèle toxique, entraînant de nombreux
arrêts thérapeutiques : seuls 84 % des patients terminent le cycle 1
en entier, et seuls 45 % finissent le cycle 4. Une hospitalisation
durant la période de chimiothérapie a été nécessaire pour 32 % des
patients. Néanmoins, malgré ces difficultés, la mortalité liée à la
chimiothérapie n’a été que de 0,8 %.
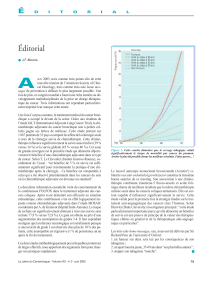
Fait fondamental, la survie globale des patients est fortement aug-
mentée dans le bras recevant la chimiothérapie adjuvante, avec
une médiane de survie de 94 mois, contre 73 mois dans le bras
sous surveillance seule, et la survie à 5 ans était respectivement
de 69 % et 54 %, soit une augmentation de plus de 10 %.
Bien que publié dans une revue majeure de recherche clinique,
cet essai n’est pas à l’abri des critiques, tant pour ce qui est de sa
méthodologie qu’en ce qui concerne sa réalisation. Sur le plan
méthodologique, nous ne connaissons pas le nombre de centres
participants et, de ce fait, le nombre moyen de patients inclus par
centre. Il n’y a pas de stratification par centre pour tempérer “l’effet
centre”. La différence entre un patient enregistré et un patient ran-
domisé (50 patients de différence) n’est pas précisée. La surveil-
lance, dans les deux bras, ne comprend qu’un examen clinique et
des radiographies pulmonaires. Une telle attitude est recevable
pour des recommandations de suivi en routine. Dans le cadre d’un
essai thérapeutique, la réalisation de scanners thoraciques réguliers
semble préférable, en particulier pour l’évaluation de la survie sans
récidive. La nature des examens réalisés peut avoir une influence
sur la durée de survie sans récidive, qui était l’objectif secondaire
de l’essai (3). Aucun curage ganglionnaire n’était exigé lors de
l’intervention chirurgicale, mais seulement une biopsie des adéno-
pathies volumineuses, ce qui laisse à penser que les “minimal N2”
(stades IIIA) ont été incorporés dans l’essai. Un tel parti pris est
difficilement concevable quand on se rappelle que le principal
reproche fait à l’essai français de chimiothérapie néoadjuvante par
les experts nord-américains était l’absence de connaissance histo-
logique du médiastin par médiastinoscopie. La procédure de ran-
domisation, enfin, n’est pas explicitée.
Dans le domaine des résultats, la principale critique tient au grand
nombre de patients qui ne remplissaient pas le cahier des charges :
50 patients disparaissaient entre la sélection et la randomisation,
41 patients randomisés ne remplissaient pas les critères d’inclusion
(8,5 %). Quatre pour cent des patients du bras traitement adjuvant
n’ont reçu aucun traitement. Il n’est pas précisé si des patients du
bras surveillance ont reçu une chimiothérapie par erreur ou s’il
s’agissait de leur décision. Le nombre de patients perdus de vue
dans l’essai est en revanche très faible.
Deux autres essais de chimiothérapie adjuvante ont été présentés
aux derniers congrès de l’American Society of Clinical Oncology
(ASCO). Le premier est américain (4). Il utilisait l’association
carboplatine et paclitaxel en situation adjuvante. Le deuxième,
coordonné par J.Y. Douillard, est français (5). Il utilisait l’asso-
ciation cisplatine et vinorelbine, là aussi en situation adjuvante.
Ces deux essais montrent une amélioration statistiquement signi-
ficative de la survie à 5 ans.
Quatre essais randomisés successifs, démontrant tous les quatre
une amélioration de la survie à 5 ans, apportent un niveau de preuve
de niveau I sur la validité du concept d’association chirurgie et
chimiothérapie. La récente méta-analyse parue dans Lung Cancer
sous la direction de T. Berghmans et al. (6) confirme la valeur
de l’association.
EN UNE RÉFÉRENCE
La chimiothérapie adjuvante
des cancers bronchiques opérés
●
A. Depierre*
193
La Lettre du Pneumologue - Volume VIII - no5 - septembre-octobre 2005
* Service de pneumologie, CHU de Besançon.
1. CALGB : Cancer and Leukaemia Group B ; ECOG : Eastern Cooperative
Oncology Group ; SWOG : South Western Oncology Group.

194
La Lettre du Pneumologue - Volume VIII - no5 - septembre-octobre 2005
Il est dorénavant admis que l’association de la chirurgie et de la
chimiothérapie est un standard opposable. Une société savante,
l’ANAES, pourrait recommander cette pratique avec un grade A.
C’est une avancée très importante en matière de traitement du can-
cer. En effet, la chimiothérapie ne se situe pas ici dans la position
palliative où elle a longtemps été cantonnée, mais en situation
curative. En détruisant définitivement les micrométastases chez
environ 10 % des patients, elle augmente d’autant plus le nombre
de patients définitivement guéris de cette terrible maladie.
■
RÉFÉRENCES BIBLIOGRAPHIQUES
1.Non-Small-Cell Lung Cancer Collaborative Group. Chemotherapy in non-
small-cell lung cancer: a meta-analysis using updated data on individual
patients from 52 randomised clinical trials. Br Med J 1995;311:899-909.
2.Arriagada R, Bergman B, Dunant A et al. Cisplatin-based adjuvant chemo-
therapy in patients with completely resected non-small-cell lung cancer.
NEngl J Med 2004;350:351-60.
3.Westeel V, Choma D, Clement F et al. Relevance of an intensive postopera-
tive follow-up after surgery for non-small-cell lung cancer. Ann Thorac Surg
2000;70:1185-90.
4.Strauss G, Herndon J, Maddaus MA et al. Randomized clinical trial of
adjuvant chemotherapy with paclitaxel and carboplatin following resection in
stage IB non-small-cell lung cancer (NSCLC): report of Cancer and Leukemia
Group B (CALGB) Protocol 9633. J Clin Oncol 2004;23:abstract 7019.
5.Douillard JY, Rosell R, Delena M et al. ANITA: phase III adjuvant vinorel-
bine (N) and cisplatin (P) versus observation (OBS) in completely resected
non-small-cell lung cancer (NSCLC) patients (pts). Final results after 70-
month median follow-up. On behalf of the Adjuvant Navelbine International
Trialist Association. Proc Am Soc Clin Oncol 2005;23:abstract 7013.
6.Berghmans T, Paesmans M, Meert AP et al. Survival improvement in resec-
table non-small-cell lung cancer with (neo)adjuvant chemotherapy: results of
a meta-analysis of the literature. Lung Cancer 2005;49:13-23.
EN UNE RÉFÉRENCE
BANDEAU ORKYN’
p. 194
1
/
2
100%