Compte-rendu de l’ESMO Milan, 8-12 octobre 2010 Abiratérone :

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
149
Échos des congrès
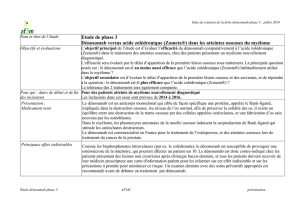
Figure 1. Étude COU-AA-31 : survie globale.
HR = 0,646 (IC95 : 0,54-0,77) p<0,0001
Survie globale après seulement une ligne :
15,4mois (abiratérone) versus 11,5mois (placebo)
Abiratérone
14,8mois (IC95 : 14,1-15,4)
Placebo
10,9mois (IC95 : 10,2-12,0)
100
60
80
40
20
100 300 5000 400 600200 700
0
Jours depuis la randomisation
Survie (%)
Abiratérone 797 728 631 475 204 25 0
Placebo 398 352 296 180 69 8 1
Compte-rendu de l’ESMO
Milan, 8-12 octobre 2010
G. Roubaud*, B. Beuselinck**, P. Beuzeboc***
Abiratérone :
résultats de l’étude de phaseIII
J. De Bono a présenté les résultats de l’étude de
phase III randomisée (2:1), en double aveugle, COU-
AA-301, comparant, dans les cancers de la prostate
métastatiques résistant à la castration après échec
d’une chimiothérapie à base de docétaxel, l’abira-
térone associé à la prednisone (n = 797) à la même
corticothérapie + placebo (n = 398). Cette étude a
inclus 1 195 patients. Elle a permis de montrer que
l’abiratérone augmente significativement la survie sans
progression (HR = 0,67 ; IC
95
: 0,59-0,78 ; p < 0,0001),
mais surtout la survie globale de 3,9 mois (14,8 mois
versus 10,9 mois ; HR = 0,65 ; IC95 : 0,55-0,77 ; p < 0,0001)
[figure 1].
Ce bénéfice en survie est retrouvé quel que soit le
sous-groupe de patients (ECOG, nombre de lignes de
chimiothérapie, type de progression, présence de méta-
stases viscérales, taux de base du PSA, des LDH ou des
phosphatases alcalines) [figure 2, p. 150].
Le taux de réponse du PSA confirmé était de 29,1 % dans
le bras abiratérone. Vingt-huit pour cent des patients
avaient reçu préalablement 2 lignes de chimiothérapie ;
le nombre moyen de cycles était de 8.
Les principaux effets indésirables ont été les rétentions
hydriques (30,5 %), l’hypokaliémie (17,1 %), l’hyper-
tension (9,7 %) et des troubles cardiaques (13,3 %), dans
la grande majorité des cas de grade 1-2.
Après le sipuleucel-T (Provenge®), le cabazitaxel et le
dénosumab, l’abiratérone s’inscrit comme la quatrième
molécule présentant des résultats positifs en 2010 lors
d’une étude de phase III et un enregistrement. Quelle
année !
Tumeurs de la vessie
Les nouveaux traitements
dans les tumeurs urothéliales
(Bellmunt J, educational session)
J. Bellmunt a présenté une synthèse de la probléma-
tique actuelle des tumeurs urothéliales en dressant
le décor de demain sur l’évaluation de nouvelles
molécules en cours de développement et en essais
cliniques. Au début de sa présentation, il a rappelé
que, au moment du diagnostic, 20 % des tumeurs uro-
théliales infiltrent le muscle et que 50 % des patients
décèdent d’une évolution métastatique dans les 2 ans. Il
y a donc un important besoin d’optimiser le traitement,
aussi bien à un stade précoce qu’à un stade avancé
de la maladie. Cette revue s’est articulée autour des
différentes voies pouvant être inhibées par des théra-
peutiques ciblées, comme celle de l’Epidermal Growth
Factor (EGFR et HER2), l’angiogenèse (VEGFR et PDGFR),
le cycle cellulaire, les inhibiteurs de Src, sans oublier
les nouveaux agents cytotoxiques. Le tableau I (p. 151)
fait la synthèse des études.
Actuellement, de toutes ces molécules testées sur la
base d’un rationnel plus ou moins robuste, seule la vin-
flunine a fait l’objet d’une étude de phase III randomisée
avec des résultats positifs (ajustés aux facteurs pronos-
tiques), se définissant comme une “option raisonnable”
en deuxième ligne des tumeurs urothéliales avancées
(Bellmunt et al., J Clin Oncol 2009).
* Département
d’oncologie médicale,
institut Bergonié, Bordeaux.
** Université catholique
de Louvain, Belgique ;
InsermU674, génomique
fonctionnelle des tumeurs
solides, université
Paris-5-René Descartes.
*** Institut Curie, Paris.

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
150
Échos des congrès
Figure 2.
Variable Sous-groupe n HR IC95
Toutes variables Tous 1 195 0,66 0,56-0,79
ECOG à l’inclusion 0-1 1 068 0,64 0,53-0,78
2 127 0,81 0,53-1,24
BPI à l’inclusion <4 659 0,64 0,50-0,82
≥4 536 0,68 0,53-0,85
Nombre de lignes
de chimiothérapie antérieures
1 833 0,63 0,51-0,78
2 362 0,74 0,55-0,99
Type de progression PSA seul 363 0,59 0,42-0,82
Radiographique 832 0,69 0,56-0,84
PSA initial au-dessus de la médiane à l’entrée Oui 591 0,65 0,52-0,81
Métastases viscérales à l’entrée Oui 709 0,60 0,48-0,74
LDH initial au-dessus de la médiane Oui 581 0,71 0,58-0,88
PAL initial au-dessus de la médiane Oui 587 0,60 0,48-0,74
Région Amérique du Nord 652 0,64 0,51-0,80
Autre 543 0,69 0,54-0,90
0,5 0,75 1 1,5
BPI : Brief Pain Inventory ; ALK-P : phosphatase alcaline.
En faveur
de l’abiratérone
En faveur
du placebo
Influence de l’âge
sur la pharmacocinétique de la vinflunine
(Tourani J et al., abstr. 570)
Les informations de cette étude pharmacocinétique
de phase I sont importantes pour 2 raisons :
✓la place récente de la vinflunine dans le traitement
des tumeurs urothéliales avancées ;
✓le terrain, car cette pathologie affecte préféren-
tiellement une population âgée avec des comor-
bidités.
Cette étude a réparti les patients en 3 groupes : 70-75 ans,
75-80 ans et plus de 80 ans, recevant respectivement
une dose de 320 mg/ m², 280 mg/ m² et 250 mg/ m² de
vinflunine pour le cycle 1. Les paramètres pharmaco-
cinétiques ont été comparés à ceux d’une population
âgée de moins de 70 ans. Quarante-six patients ont été
traités. Concernant l’étude pharmacocinétique, la clai-
rance de la vinflunine décroît parallèlement à celle de
la créatinine. Les paramètres pharmacocinétiques sont
inchangés dans la population 70-75 ans comparative-
ment à la population témoin. Aucun décès toxique n’a été
rapporté. Les toxicités de grade 3-4 les plus fréquentes
ont été la neutropénie (73 %), la constipation (63 %) et
l’asthénie (56 %), sans aucun lien entre l’incidence de
ces événements et l’âge. Il est donc possible d’utiliser
cet appariement groupe d’âge/dose de vinflunine pour
la prescription de cette molécule en pratique clinique.
Efficacité du pazopanib en monothérapie
chez les patients réfractaires
ou en rechute après une première ligne
de chimiothérapie standard
(Nechi A et al., INT70/09, NCT01031875)
Cette étude de phase II a évalué le pazopanib (inhibiteur
de tyrosine kinase anti-VEGF et PDGF) dans les tumeurs
urothéliales réfractaires ou en rechute après au moins
une première ligne standard à base de cisplatine. Le
pazopanib a été administré à la dose de 800 mg/ j jusqu’à
progression à une population de 18 patients, dont
8 avaient une tumeur du haut appareil et 16 de mul-
tiples sites métastatiques (médiane 2 [1-4]). L’évaluation
était faite par scanner et par PET scan au 18-FDG. Les
résultats sont très encourageants, avec 22 % de réponse
partielle, 83 % de maladie stable (avec bénéfice clinique)
et une toxicité modérée. Il est à noter que les deux tiers
des patients ont presenté une évolution nécrotique

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
151
Compte-rendu de l’ESMO
Tableau I.
Nouveaux cytotoxiques Stade avancé (localement évolué ou métastatique)
1re ligne ≥ 2e ligne
Pémétrexed (antifolate) Phase II
(+G)
– Von der Maase, Ann Oncol 2006
➔ comparable à G seule
Phase II
– Sweeney, J Clin Oncol 2006
– Galsky, Invest New Drugs 2007
MSKCC
Pralatrexate (antifolate) Phase II : en cours
Larotaxel XRP9881 (taxane) Phase II : arrêtée (manque d’efficacité)
NCT00625664
Abraxane ABI-007
(taxane lié à l’albumine)
Phase II*
Ixabépilone (analogue épothilone B) Phase II : 42 patients/5 réponses partielles
– Dreicer, Cancer 2007
Éribuline (inhibiteur dynamique de croissance
des microtubules)
Phase I, phase I/II : en cours (patients avec IR)
Vinflunine (4e génération vinca-alcaloïdes) Phase II
– Vaughn, Cancer 2009
– Culine, Br J Cancer 2006
Phase III
– Bellmunt, J Clin Oncol 2009 versus soins de support
➔ ”option raisonnable” 2e ligne
Thérapeutiques
ciblées En développement Néo-adjuvant Stade avancé
(localement évolué ou métastatique)
1re ligne ≥ 2e ligne
Voie EGFR Phase II : erlotinib
– Pruthi, B J Urol 2010
Phase II : géfitinib + GC
– Philips, Ann Oncol 2009
Phase II :
• Cétuximab + GC 1re ligne
• NCT00645593 (en cours d’inclusion)
Voie HER2 Phase II
trastuzumab
(en cours)
Phase I : lapatinib + GC
Phase II : lapatinib
– Wülfing, Cancer 2009
Voie FGFR3 AACR 2008, abstr. 4888 Phase II :
• TKI 258 (dovitinib), en cours
• NCT00790426
Angiogenèse Phase II
• bévacizumab + GC
18 réponses partielles,
6 réponses
complètes/36 patients
évaluables
ASCO 2009, abstr. 5018
• sorafénib : 4 MS
ASCO GU 2008, abstr. 340
• sunitinib : patients unfit
2 réponses partielles
Bénéfice clinique : 64 %
ASCO GU 2008, abstr. 291
Phase III
• bévacizumab (en cours)
• NCT00942331
étude CALGB
Phase II
• vandétanib-docétaxel
• NCT00378794
• pazopanib
• NCT01031875*
• NCT00471536
• sunitinib
2 réponses partielles, 43 % MS
– Gallagher, J Clin Oncol 2009
Inhibiteur Src Phase II
• Dasatinib
NCT00706641
Cycle cellulaire • inhibiteurs des checkpoint
kinases
: sensibiliser les cellules
ayant une fonction p53
déficiente
Phase II
• inhibiteur de la KSP AZD4877 (NCT00661609)
Essai négatif
IR : insuffisance rénale ; MS : maladie stable ; G : gemcitabine ; C : cisplatine ; MSKCC : Memorial Sloan Kettering Cancer Center ; KSP : kinesin spindle protein ; unfit : non éligible pour une chimiothérapie à base de cisplatine.
* Abstracts détaillés ci-dessous.

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
152
Échos des congrès
Figure 3. Augmentation du risque fracturaire.
Thérapie de privation androgénique
Pas de thérapie de privation androgénique
20
16
14
12
8
6
2
18
10
4
12,6
19,4
Shahinian 20051
(1-5 années)
6,5
7,9
Smith 20062
(>12 années)
12,7
17,2
Alibhai 20103
(6,7 années)
0
Taux de fractures par personne
par année (%)
1 Shahinian et al., NEngl JMed 2005;154-64.
2 Smith et al., J Clin Oncol 2006;24:4448-56.
3 Alibhai et al., J Urol 2010;184:918-24.
et/ ou une diminution de la SUV (standard uptake value)
au niveau des lésions métastatiques. Les données de
survie ne sont pas encore disponibles, le recul médian
étant de 3 mois. Cet essai souligne l’efficacité d’une
monothérapie ciblant la voie du VEFG et du PDGF dans
une population de patients de mauvais pronostic. Un
essai de phase II du National Cancer Institute évaluant
la même molécule est en cours.
Efficacité de l’ABI-007 ou abraxane,
une nouvelle génération de taxanes
liés à l’albumine
(Ko Y et al., ref ?)
Y. Ko a rapporté les résultats intermédiaires d’une phase
II testant l’efficacité de l’abraxane en monothérapie
(260 mg/ m2 toutes les 3 semaines) en deuxième ligne
après une chimiothérapie à base de cisplatine sur une
population de 46 patients (40 patients évaluables pour
la réponse). Un taux de réponse objective de 27,5 %
(1 RC ; 10 RP) et un taux de bénéfice clinique de 50 %
ont été rapportés. La douleur, l’hypertension artérielle,
la fatigue et les arthralgies représentaient les toxicités
de grade 3 les plus fréquentes. Il n’y a pour l’instant
pas de données de survie dans cette étude, mais on
pourrait espérer une place pour l’ABI-007 parmi les
taxanes avec une moindre toxicité (meilleure sélectivité)
comme option de deuxième ligne dans le traitement
des tumeurs urothéliales avancées.
Métastases osseuses et cancers
uro génitaux : mise à jour des traitements
ciblant l’os et émergence du dénosumab…
Le dénosumab
À ce jour, les seules thérapies inhibitrices de la résorp-
tion osseuse approuvées et utilisées en pratique quo-
tidienne sont les bisphosphonates. Plusieurs autres
molécules sont en cours de développement, parmi
lesquelles le dénosumab, un anticorps monoclonal
humain anti-RANK-ligand (Receptor Activator for Nuclear
Factor kappa B).
Le RANK-ligand, exprimé par les ostéoblastes, est
nécessaire à la stimulation, la formation et la matu-
ration des ostéoclastes, qui disposent d’un récepteur
RANK. Le dénosumab bloque cette interaction cellu-
laire et freine ainsi l’activation des ostéoclastes et la
résorption osseuse.
Les résultats de plus en plus nombreux d’études de
phase III avec le dénosumab dans différentes tumeurs,
notamment urogénitales, ont fait partie des nou-
velles les plus importantes concernant les métastases
osseuses à l’ESMO 2010.
Initialement développés pour leur effet antiostéoporo-
tique ou pour prévenir les complications squelettiques
des métastases osseuses (Skeletal Related Events [SRE] :
fractures pathologiques, hypercalcémie, compressions
médullaires, douleurs osseuses, nécessitant dans
bien des cas un traitement par radiothérapie ou par
chirurgie), ces produits sont de plus en plus étudiés
pour leur effet antitumoral.
Prévention de l’ostéoporose induite
par la privation androgénique
B. Tombal (Louvain, Belgique) a présenté les résultats
de l’essai de phase III de prévention par le dénosumab
de l’ostéoporose induite par le traitement hormonal
des cancers de la prostate métastatiques. La priva-
tion androgénique augmente de façon importante
le risque de fractures (figure 3). La baisse du taux
d’androgènes provoque une diminution du taux d’es-
trogènes, responsable d’une réduction de l’activité
ostéoblastique et d’une augmentation de l’activité
ostéoclastique (figure 4). Le dénosumab, en inhibant
la formation, la fonction et la survie des ostéoclastes,
diminue ainsi la résorption osseuse et l’incidence de
l’ostéoporose (figure 5). L’objectif principal de cette
étude, qui a inclus 1 468 patients (schéma 1), était
la mesure de la diminution à 24 mois de la densité
minérale au niveau du rachis. Comparé au placebo, le
dénosumab augmente de façon significative la densité
minérale osseuse à 24 mois et réduit de façon signifi-

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
153
Compte-rendu de l’ESMO
Figure 5. Le dénosumab inhibe la formation, la fonction et la survie des ostéoclastes et diminue ainsi la
résorption osseuse et l’incidence de l’ostéoporose (Adapté de Boyle et al., Nature 2003;423:337-42. Lewiecki,
Exper Opin Biol Ther 2006;6:1041-50. McClung et al., New Engl J Med 2006;354:821-31).
Ablation hormonale Inhibition
RANK ligand
Diminution de
la formation
osseuse
Inhibition des ostéoclastes
(formation, fonction, survie)
Résorption
osseuse
Ostéoblaste
Ostéoclaste
Inhibiteur RANK ligand
Figure 4. La diminution du taux d’androgènes provoque une diminution du taux d’œstrogènes. En consé-
quence, l’activité ostéoblastique diminue et l’activité ostéoclastique augmente (Adapté de Boyle et al., Nature
2003;423:337-42. Lewiecki, Exper Opin Biol Ther 2006;6:1041-50. McClung et al., New Engl J Med 2006;354:821-31).
Diminution
de l’activité
des ostéoblastes
Augmentation
de l’activité
ostéoclastique Augmentation
de la résorption
osseuse
Ostéoclaste
(résorption
osseuse)
Ostéoblaste
(formation osseuse)
RANK-ligand
RANK
Schéma 1. Schéma de l’étude de phase III dénosumab versus placebo.
Critères d’inclusion
• Maladie non métastatique
• Thérapie de privation androgénique continue
• ≥70ans ou <70ans avec :
– ou antécédents de fracture sur base d’ostéoporose,
– ou T-score à l’ostéodensitométrie <– 1,0
à la hauteur de la colonne vertébrale, du bassin
ou du col du fémur
• Thérapie de privation androgénique de plus de 12mois
ou patient ayant subi une orchidectomie bilatérale
• performance ECOG 0, 1 ou 2
Objectif principal : pourcentage de diminution de la densité osseuse
à la hauteur de la colonne vertébrale à 24 mois
Inclusion 36 mois
Smith et al., NEngl JMed 2009;361:745-55.
Supplément de calcium
et de vitamine D
Dénosumab
60 mg s.c.
tous les 6 mois
Placebo
s.c.
tous les 6 mois
RANDOMISATION
n = 1 468
cative l’incidence de nouvelles fractures vertébrales :
– 84 % à 12 mois, – 70 % à 24 mois et – 62 % à 36 mois
(figure 6, p. 154).
Diminution de l’incidence des événements
indésirables osseux liés aux métastases
dans les études randomisées
K. Fizazi (institut Gustave-Roussy) a présenté les résul-
tats de l’étude de phase III de l’effet du dénosumab sur
l’incidence des SRE.
Il a d’abord rappelé les résultats obtenus avec l’acide
zolédronique dans le cancer de la prostate. Dans une
étude contrôlée versus placebo (643 malades), F. Saad
avait étudié l’effet de l’acide zolédronique (J Natl Cancer
Inst 2002) : 33 % des malades sous acide zolédronique
avaient présenté un ou plusieurs SRE, versus 44,2 %
des sujets du groupe placebo (p = 0,021). Il était aussi
retrouvé une augmentation significative du temps
jusqu’au premier SRE.
Dans une étude de phase II ayant comparé le switch
pour le dénosumab versus la poursuite de l’acide zolé-
dronique chez des malades atteints de métastases
osseuses, le dénosumab normalisait plus fréquemment
que l’acide zolédronique le taux de uNTx et prévenait
plus souvent les SRE (Fizazi et al., J Clin Oncol 2009).
L’étude de phase III dénosumab versus acide zolédro-
nique chez les malades atteints d’un cancer de la pro-
state résistant à la castration avec métastases osseuses
et sans traitement préalable par bisphosphonates a
inclus 950 patients dans le bras dénosumab (120 mg
s.c. toutes les 4 semaines) et 951 malades dans le bras
acide zolédronique (4 mg i.v. toutes les 4 semaines)
[schéma 2, p. 154]. L’objectif principal était le temps
jusqu’au premier SRE (non-infériorité). L’objectif secon-
daire consistait à étudier le temps jusqu’au premier SRE
et jusqu’au SRE suivant. Les 2 bras étaient bien équilibrés
concernant les caractéristiques de départ. L’étude a
montré que le dénosumab prolongeait le temps jusqu’au
premier SRE de façon significative, avec une réduction
du risque de 18 % : 17,1 mois avec l’acide zolédro-
nique versus 20,7 mois avec le dénosumab (HR = 0,82 ;
p = 0,0002) [figure 7, p. 154]. Les marqueurs du méta-
bolisme osseux (uNTx et BSAP, un marqueur d’activité
ostéoblastique) diminuaient plus sous dénosumab que
sous acide zolédronique (figure 8, p. 154).
Les effets indésirables dans les 2 groupes étaient
comparables. Une ostéonécrose de la mâchoire a été
constatée chez 1,3 % des malades traités par acide zolé-
dronique et 2,3 % des malades traités par dénosumab. Il
y avait un peu plus d’insuffisance rénale dans le groupe
acide zolédronique (16,2 %) que dans le groupe déno-
sumab (14,7 %). Dans le bras acide zolédronique, 22,5 %
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%