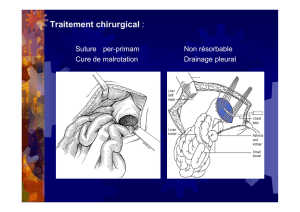
Les checs des anastomoses colo-rectales

FCC 4 - Les échecs des anastomoses colorectales : quel traitement?
SOMMAIRE
Président :
Y. PANIS (Clichy)
Modérateurs
F. BRETAGNOL (Clichy)
S. BENOIST (Kremlin Bicêtre)
Positionnement du problème
F. BRETAGNOL (Clichy
)
Quand proposer un geste chirurgical par voie locale ? Avec quel succès ?
S. BENOIST (Kremlin Bicêtre)
Quand proposer une réintervention par voie abdominale l'expérience de
Beaujon
Y. PANIS (Clichy)
Y a-t-il une place pour le traitement endoscopique ?
M. BARTHET (Marseille)

FCC 4 - Les échecs des anastomoses colorectales : quel traitement?
ECHECS DES ANASTOMOSES COLORECTALES : POSITIONNEMENT DU
PROBLEME
Frédéric Bretagnol
Service de Chirurgie Colorectale
Pôle des Maladies de l’Appareil Digestif (PMAD)
Hôpital Beaujon – Clichy.
La fistule anastomotique (FA) représente la complication immédiate la plus fréquente après chirurgie
colorectale. Dans l’étude récente multicentrique de l’Association française de Chirurgie, après chirurgie rectale
pour cancer, le taux de morbidité chirurgicale était de 27% incluant un taux de FA clinique égal à 12% avec un
risque de réopération chirurgicale de 12% (1). Dans notre expérience, le taux de sepsis global après résection
rectale pour cancer chez 200 patients, était de 13,5% incluant un taux de FA avec abcès dans 7% des cas, une
péritonite dans 4,5% des cas et une taux de sepsis péri-anastomotique (abcès isolé et fistules recto-vaginales)
dans 2% des cas (2).
Les conséquences des FA ne sont pas négligeables puisque certains auteurs ont souligné le risque de mortalité
péri opératoire mais aussi à long terme le risque oncologique en terme de récidive locale et de survie (3).
Mais les échecs à moyen et long terme sont essentiellement représentés par le risque de séquelles
fonctionnelles digestives et particulièrement le risque de stomie définitive, mais aussi le risque de sepsis
chronique et de sténose anastomotique. Dans notre expérience (4), nous avons rapporté 33 patients réopérés
pour échec après anastomose colorectale. Les indications opératoires étaient une sténose anastomotique
(53%), une stomie terminale (Hartmann) (17%), une fistule chronique (15%) et une récidive néoplasique (15%).
Il semble apparaître que la prise en charge immédiate du sepsis joue un rôle primordial dans le devenir d’une
anastomose colorectale. En effet, dans notre expérience (2) incluant 25 patients présentant une FA clinique
après chirurgie rectale, le traitement était médical dans 22% des cas, un drainage radiologique ou transanal
dans 37% des cas et une réopération dans 41% des cas incluant une conservation de l’anastomose chez plus de
deux-tiers des patients et une colostomie terminale (Hartmann) dans 27% des cas. Nous avons montré que le
risque global de stomie définitive était de 3% et de 22% après FA clinique. De plus, ce risque était de 13% après
réopération et conservation sphinctérienne alors qu’il était de 100% après Hartmann, soulignant l’intérêt dans
la mesure du possible de conserver l’anastomose colorectale.
Peu d’études sont disponibles sur le risque et la prise en charge des FA chroniques (5,6). Fong et al ont
rapporté récemment leur expérience de prise en charge à propos de 8 patients présentant une fistule
chronique (5). Ces auteurs concluaient à un taux de stomie définitive de 25% avec un risque nul en cas de FA
radiologique, un risque élevé en cas d’abcès associé à la FA clinque avec une risque de séquelles fonctionnelles
digestives non négligeables chez plus de deux-tiers des patients.
En pratique, dans la littérature, le risque de stomie définitive varie de 19 à 25% après chirurgie rectale et dans
la majorité des cas, ce risque est corrélé au risque de sepsis pelvien post opératoire (56 à 85% des cas) (7,8).

FCC 4 - Les échecs des anastomoses colorectales : quel traitement?
Plusieurs autres facteurs de risque ont été mis en évidence : Age > 70 ans, confection secondairement pour
sepsis d’une stomie, stomie terminale, récidive carcinologique, comorbidité du patient.
La sténose anastomotique représente la cause la plus fréquente d’échec d’une ACR. Son incidence varie de 3 à
30%, même s’il est difficile de la préciser car sa définition varie d’une étude à l’autre (9,10). Ambrosetti et al (9)
ont montré que 32% patients après sigmoïdectomie pour diverticulose présentaient des signes occlusifs alors
qu’une sténose (diamètre < 12 mm) n’était mise en évidence que seulement chez 17% des ces patients. Par
ailleurs, une dilatation endoscopique a été nécessaire que chez 14% des patients. il existe donc un manque de
consensus dans l’étude du risque de sténose anastomotique du fait du manque de corrélation entre les
symptômes, la définition endoscopique ou radiologique et la nécessité d’un traitement. Plusieurs facteurs
prédictifs de sténose ont été rapportés outre la FA post opératoire tels que : obésité, sexe masculin,
radiothérapie, le diamètre de l’agrafage circulaire < 29 ou 31 ainsi que la section de l’artère mésentérique
inférieure.
En conclusion, la FA est la complication principale après chirurgie colorectale avec une incidence variant de 5 à
30%. Le risque de stomie définitive en cas de sepsis pelvien est de 25%. La prise en charge immédiate
conditionne le futur de l’anastomose colorectale avec la nécessité autant que possible de conserver
l’anastomose même en cas de réopération.
Les échecs à moyen-long terme sont représentés par le risque de sténose anastomotique et de sepsis
chronique.
Il existe un manque de consensus quant à la définition exacte de la sténose anastomotique. Son incidence varie
de 5 à 25% et nécessite une dilatation endoscopqiue dans 10% des cas et une réfection de l’anastomose dans
5% des cas.
Ces échecs posent le problème de leur prise en charge. Faut il proposer un traitement endoscopique ? Quelle
est la place de la chirurgie locale et abdominale ? et surtout quels sont les résultats opératoires de cette
chirurgie le plus souvent difficile et quelles en sont les séquelles fonctionnelles à moyen terme ?
Références
1. Cancer du rectum. Rapport de l’Association Française de Chirurgie. 2009
2. Magiorri L, Bretagnol F, Lefevre JH, Ferron M, Vicaut E, panis Y. Conservative management is
associated with a decreased risk of definitive stoma after anastomotic leakage complicating sphincter-
saving resection for rectal cancer. Colorectal Dis 2011;13:632-7.
3. Mathiessen P, Hallbook O, Rutegard J, Sjodhal R. Population-based study of risk factors for
postoperative death after anterior resection of the rectum. Br J Surg 2006;93:498-503
4. Lefevre JH, Bretagnol F, maggiori L, Ferron M, Alves A, Panis Y. Redo surgery for failed colorectal or
coloanal anastomosis : A valuable surgical challenge. Surgery 2011;149:65-71.
5. Fong SS, Chen K, Sim R. Chronic anastomotic sinus after low anterior resection : when can the
defunctioning stoma be reversed ? Colorectal Dis 2011;13:644-9.

FCC 4 - Les échecs des anastomoses colorectales : quel traitement?
6. Van Koperen PJ, Van der Zaag ES, Omloo JMT, Slors JFM, Bemelman WA. The persisting presacral sinus
after anastomotic leakage following anterior resection or restorative protocolectomy. Colorectal Dis
2010;13:26-30;
7. Lindgren R, Hallbook O, Rutegard J, Sjodahl R, Mathiessen P. Does a defunctionaing stoma affect
anorectal function after low rectal resection ? Results of a randomized multicenter trial. Dis Colon
Rectum 2011;54:747-52.
8. David GG, Slavin JP, Willmott S, Corless DJ, KhanAU, Selvasekar CR. Loop ileostomy following anterior
resection: is it really temporary ? Colorectal Dis 2010;12:428-32
9. Ambrosetti P, Francis K, De Peyer R, Frossard JL. Colorectal anastomotic stenosis after elective
laparoscopic sigmoidectomy for diverticular disease : A prospective evaluation of 68 patients. Dis
Colon Rectum 2008;51:1345-59.
10. Bannura GC, Cumsille MAG, Barrera AE, Contreras JP, Melo CL, Soto DC. Predictive factors of stenosis
after stapled colorectal anastomosis : Prospective analysis of 179 consecutive patients. World J Surg
2004;28:921-5.

FCC 4 - Les échecs des anastomoses colorectales : quel traitement?
QUAND PROPOSER UN GESTE CHIRURGICAL PAR VOIE LOCAL ? AVEC QUEL
SUCCES ?
Stéphane Benoist
Service de Chirurgie Oncologique et Digestive
CHU Bicêtre, 94275 Kremlin Bicêtre
Introduction
La fistule anastomotique est la complication spécifique la plus fréquente et probablement la plus difficile à
prendre en charge après une chirurgie d’exérèse rectale et une anastomose colorectale. Ce risque de désunion
anastomotique varie entre 5 et 20% et il est d’autant plus élevé que l’anastomose colo-rectale est basse (1).
Outre les conséquences immédiates, liées au sepsis, les fistules anastomotiques ont des conséquences
sérieuses à long terme pouvant être responsable d’un véritable échec de l’anastomose colorectale. Les
principales causes d’échecs de ces anastomoses colorectales sont la sténose anastomotique cicatricielle, et la
persistance d’une fistule anastomotique chronique qui peut communiquer soit avec la cavité pelvienne et être
responsable d’un sepsis pelvien chronique, soit avec le vagin chez la femme et l’urètre chez l’homme et
constituer une fistule recto-vaginale ou urétro-rectale chronique. Pour toute ces complications tardives, de
multiple traitements endoscopiques ou chirurgicaux peuvent être proposés par mi les quels les gestes
chirurgicaux par voie locale ont une place.
Place des gestes chirurgicaux par voie locale en cas de stenose anastomotique
En cas de conservation de l’anastomose colorectale lors de la prise en charge initiale de la fistule
anastomotique, une sténose séquellaire de l’anastomose peut survenir dans 20 à 30% des cas (2-3). Cette
sténose, qui est le plus souvent asymptomatique du fait de la présence d’une stomie en amont, est en générale
diagnostiquée, lorsqu’un rétablissement de la continuité est envisagé, soit par un toucher rectal (qui permet de
différentier les sténoses vraies des simples diaphragmes facilement effondrés au doigt) lorsque l’anastomose
est basse soit par une opacification lorsqu’elle est plus haut située. Pour la prise en charge de ces sténoses, il
convient de distinguer les sténoses isolées pour les quelles il y a une place pour les traitements par voie locale
et celles qui sont associées à une fistule persistante pour les quelles une réintervention par voie haute est
quasiment toujours nécessaire.
En cas de sténose sans fistule associée, il convient de distinguer les anastomoses très basses et celles plus
haut situées.
- En cas de sténose isolée d’une anastomose basse, il faut toujours commencer par réaliser une ou
plusieurs séances de dilatation à la bougie sous anesthésie générale, dans la mesure ou il s’agit
d’une technique simple qui ne compromet pas un geste ultérieur et qui permet la guérison de la
fistule dans près de 30% des cas (4). En cas d’échec des dilatations qui est le plus souvent du au fait
qu’au niveau de l’anneau de striction, il n’existe plus de muqueuse saine permettant d’éviter une
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%