La Lettre de L’Hépato-Gastroentérologue - n° 1 - février 1998 27
D
O S S I E R T H É M A T I Q U E
es formes avancées des cancers gastriques compren-
nent les tumeurs localement avancées non résécables
et les formes métastatiques. Les premières peuvent
parfois bénéficier d’un traitement médical agressif pour espérer
devenir secondairement accessibles à une résection chirurgicale
complète et laissent donc la place aux traitements combinés
médico-chirurgicaux. En cas de métastases, la survie spontanée
est catastrophique avec une médiane n’excédant pas 6 mois et
seule une chimiothérapie à visée palliative peut être actuelle-
ment proposée.
LA CHIMIOTHÉRAPIE DES FORMES MÉTASTATIQUES
Les principales drogues efficaces
En chimiothérapie, l’efficacité antitumorale d’une drogue est
essentiellement analysée dans des études de phase II sur le taux
de réponse objective (RO) qui regroupe les taux de réponse
complète (RC) et de réponse partielle (RP) définis selon les cri-
tères OMS. Les principales molécules testées en monothérapie
dans ce type d’études donnent des taux de RO compris entre 10
et 30 %(1) avec des durées brèves (3 à 6 mois) et pratiquement
jamais de RC.
Comme pour tous les cancers digestifs, la principale drogue uti-
lisée reste le 5-fluorouracile avec des taux de RO aux alentours
de 20 %. Les autres molécules donnant des taux de RO compa-
rables sont la mitomycine C, l’adriamycine et le cisplatine.
Cependant, le caractère ancien de certaines études doit rendre
prudent dans l’interprétation de ces résultats, compte tenu de la
moindre précision dans l’évaluation de la réponse tumorale en
l’absence de scanners relus par des radiologues extérieurs aux
études. D’autres produits comme les nitrosourées ou l’étoposi-
de pourraient aussi avoir une certaine activité à un degré
moindre. En revanche, le carboplatine, dérivé du cisplatine lar-
gement utilisé dans les cancers ovariens, n’a ici aucune effica-
cité comparable au cisplatine et donc aucune place. Parmi les
nouvelles molécules, les taxanes semblent avoir une activité
intéressante dans les cancers œsogastriques, notamment le
docetaxel (Taxotère
®
) avec un taux de réponse de 24 % observé
chez 33 patients. La place de l’irinotécan (Campto
®
), du ratil-
trexed (Tomudex
®
) et de l’oxaliplatine (Eloxatine
®
) est aussi en
cours d’évaluation, alors que la gemcitabine (Gemzar
®
) n’a ici
aucune efficacité.
Les principales associations de drogues (polych i m i o t h é ra p i e s )
De très nombreuses études de phase II ont été réalisées pour
sélectionner des associations chimiothérapiques efficaces avec
des résultats très médiocres avant les années 90. Parmi les
divers protocoles de polychimiothérapie décrits en phase II, une
distinction peut être faite selon la présence ou non de cisplatine
dans ces associations.
Les polychimiothérapies sans cisplatine
• Le protocole FAM : Associant 5-FU, adriamycine et mitomy-
cine C, il a suscité quelques espoirs dans les années 80 avec des
taux de RO atteignant 40 % dans les premières études avec
cependant très peu de RC ( 2 ) et une médiane de survie de l’ordre
de 7 mois. Les résultats ultérieurs ont ensuite été décevants avec
des taux de RO compris entre 10 et 30 %, au prix d’une toxicité
non négligeable, surtout hématologique. Le remplacement de
l’adriamycine par l’épiadriamycine a eu l’avantage de diminuer
la toxicité cardiaque avec une efficacité comparable au FA M .
Cependant, ce schéma doit maintenant être abandonné compte
■
La chimiothérapie des formes métastatiques des cancers de
l’estomac améliore la qualité de vie par rapport au traitement
symptomatique.
■
Bien que le bénéfice en termes de survie soit très modeste,
le fait d’avoir reçu une chimiothérapie est un facteur pronos-
tique significatif.
■
Il n’existe pas actuellement de protocole de chimiothérapie
faisant l’objet de consensus.
■
Les patients opérables présentant des cancers gastriques
inextirpables mais non métastatiques justifient d’une chimio-
thérapie car elle autorise parfois secondairement une résec-
tion complète associée à une survie qui peut être prolongée.
■
Les formes avancées des cancers gastriques restent de pro-
nostic très sombre avec des médianes de survie globales n’at-
teignant pas 1 an.
P O I N T S F O R T S
P O I N T S F O R T S
Cancers de l’estomac : traitement des formes avancées
•M. Ychou*
L
* CRLC Val d’Aurelle, Montpellier.

La Lettre de L’Hépato-Gastroentérologue - n° 1 - février 199828
D
O S S I E R T H É M A T I Q U E
tenu des résultats des études de phase III que nous analyserons
plus loin.
•Le protocole FAMTX : Le FAMTX comprend l’administra-
tion de méthotrexate à forte dose (1,5 g/m
2
) à J1 avec rattrapage
par l’acide folinique (AF) à la 24
e
heure, le 5-FU à haute dose
(1,5 g/m
2
) à J1 et l’adriamycine (30 mg/m
2
) à J14, le tout admi-
nistré tous les 28 jours. Ce protocole a permis d’obtenir en
phase II, chez 67 patients évaluables, 33 % de RO dont 9 RC,
avec cependant 4 décès toxiques dont 3 liés à un non-respect du
protocole. En effet, cette association est délicate à utiliser
comme protocole de routine dans la mesure où elle impose des
règles strictes dans la manipulation du méthotrexate avec hydra-
tation, alcalinisation des urines et détermination de la métho-
trexatémie pour adaptation des doses d’AF ; il est de plus
contre-indiqué en cas d’épanchement ou d’hypoalbuminémie.
Le remplacement de l’adriamycine par l’épirubicine ne semble
pas modifier son efficacité (protocole FEMTX).
•Associations 5F-U-acide folinique :La modulation du 5-FU
par l’AF, dont l’efficacité a bien été démontrée dans les cancers
colorectaux, a aussi été évaluée dans les cancers gastriques.
Dans une étude initiale datant de 1986, le schéma FU-FOL
décrit par Machover (5 jours par mois) a donné 13 RO sur 27
patients évaluables (48 %) avec une médiane de survie de seu-
lement 5,5 mois. Cette efficacité en termes de réponse tumora-
le a été retrouvée avec le schéma LV5-FU2 qui a donné 43 % de
RO sur 23 patients évaluables, dont certains prétraités avec une
médiane de survie toujours faible, de 6 mois pour les patients en
première ligne. Enfin, l’adjonction d’étoposide (VP-16) au 5-
FU-AF a permis d’évaluer le protocole ELF qui, dans un essai
initial publié en 1991 chez 51 patients âgés de plus de 65 ans ou
avec antécédents cardiaques, a permis d’obtenir un taux de RO
élevé de 53 %, mais qui n’a pas été confirmé à ce niveau élevé
dans les études ultérieures. Quoiqu’il en soit, la modulation du
5-FU par l’AF a démontré une certaine activité dans les adéno-
carcinomes gastriques au prix d’une toxicité relativement faible.
Les polychimiothérapies contenant du cisplatine
Parmi les très nombreuses combinaisons comportant du cispla-
tine, au moins 3 ressortent actuellement de la littérature comme
étant les plus actives.
•Le protocole EAP :Une association lourde comportant l’éto-
poside, l’adriamycine et le cisplatine a été rapportée initiale-
ment comme très active en termes de taux de réponse avec 51 %
de RO dont 15 % de RC chez 55 adénocarcinomes gastriques
métastatiques (3). Les études ultérieures n’ont cependant pas
confirmé ces résultats favorables, le pourcentage de RO étant,
dans une autre étude de phase II publiée en 1992 par Lerner et
coll., de 33 % dont 8 % de RC qui s’accompagnaient malheu-
reusement de 4 décès (11%) dus à la toxicité, en particulier
médullaire.
• Le protocole FP :Plus récemment, l’association de cisplatine
et de 5-FU en perfusion continue sur 5 jours s’est révélée inté-
ressante avec un assez bon rapport efficacité/tolérance. Sur 3
études de phase II publiées (4, 5, 6) avec un protocole FP simi-
laire, les taux de RO sont très comparables, respectivement de
41, 48 et 43 % sur un total de 114 patients traités avec quelques
cas de RC. La toxicité est essentiellement digestive, hématolo-
gique et rénale mais en général assez bien contrôlée maintenant,
tant la généralisation de ce type de protocole est grande.
• Le protocole ECF : Il s’agit du schéma le plus récemment
décrit comme efficace dans les cancers gastriques métastatiques
en associant le 5-FU, l’épirubicine et le cisplatine selon le sché-
ma préconisé par Findlay et coll. (7) : le 5-FU est administré à
la dose de 200 mg/m
2
/j en perfusion continue pendant 21
semaines, l’épirubicine et le cisplatine étant donnés en perfu-
sion courte une fois tous les 21 jours respectivement à la dose
de 50 et 60 mg/m
2
. Ces auteurs ont ainsi rapporté les résultats
d’une étude de phase II comportant 128 patients porteurs d’un
adénocarcinome œsogastrique avancé et mesurable avec un
taux de RO de 71 % dont 12 % de RC. Ces bons résultats ont
récemment été confirmés par une autre étude de phase II ita-
lienne.
Les principales études randomisées
• Essais comparant la chimiothérapie à l’absence de chimiothé-
rapie : Nous disposons actuellement de 3 études randomisées
publiées ayant posé la question de l’intérêt en termes de survie
de proposer une chimiothérapie pour un adénocarcinome gas-
trique métastatique par rapport à un simple traitement sympto-
matique.
La première (8) a comparé un schéma FAMTX modifié (dimi-
nution de la dose de MTX à 1 g/m
2
) à un groupe contrôle sans
chimiothérapie. La randomisation a été interrompue après l’in-
clusion de 22 patients (10 dans le bras contrôle et 12 dans le
bras chimio) en raison d’un bénéfice de survie très significatif
en faveur de la chimiothérapie (médiane de survie passe de 9
mois à 3 mois, p =0,001). Cependant, la méthodologie de cette
étude est très contestable car l’analyse de survie est faite avec
18 patients supplémentaires inclus dans le bras chimiothérapie
sans randomisation et l’effectif reste au total très faible.
Méthodologiquement plus rigoureuse est la deuxième étude (9)
qui a comparé une chimiothérapie similaire en remplaçant
l’adriamycine par l’épirubicine (FEMTX) à un traitement de
confort sans chimiothérapie mais comprenant des vitamines A
et E. Là aussi, on constate une amélioration significative de la
survie globale (5,4 mois versus 1,7 mois, p = 0,0006) après ran-
domisation de 41 patients. La médiane de survie du bras contrô-
le paraît cependant particulièrement courte dans cette étude et
l’effectif global reste aussi assez faible. Enfin, encore plus
convaincante est la publication de Glimélius et coll. en 1997
(10) qui a randomisé 61 patients entre chimiothérapie +
meilleur traitement symptomatique contre le meilleur traitement
symptomatique seul. La chimiothérapie était soit le protocole
ELF, soit la même association 5-FU-AF mais sans étoposide.

La Lettre de L’Hépato-Gastroentérologue - n° 1 - février 1998 29
Malgré un meilleur état général des patients dans le bras contrô-
le et le fait que 12 patients de ce bras ont finalement reçu une
chimiothérapie, la médiane de survie est plus longue dans le
bras chimiothérapie (8 mois versus 5 mois), mais avec une dif-
férence non significative (p = 0,12). Cependant, dans un modè-
le de Cox testant l’influence des principaux facteurs pronostics,
dont l’état général, le fait d’avoir reçu une chimiothérapie est un
facteur indépendant de survie significatif (p = 0,03). De plus,
l’intérêt majeur de cette étude consiste en l’évaluation de la qua-
lité de vie par le questionnaire EORTC-QLQ-C30 qui montre
que 45 % des patients du bras chimiothérapie ont une améliora-
tion de leur qualité de vie d’une durée minimum de 4 mois
contre seulement 20 % dans le bras contrôle (p < 0,05).
Au total, il existe maintenant suffisamment d’arguments pour
conclure que la chimiothérapie augmente modestement mais
significativement la survie des cancers gastriques avancés, avec
une amélioration de la qualité de vie démontrée pour un proto-
cole peu toxique.
• Essais comparant une polychimiothérapie au 5-FU seul : Dès
1985, on pouvait conclure à l’absence d’intérêt du protocole
FAM puisqu’était publiée une étude de phase III ayant rando-
misé 151 patients qui trouvait une survie identique dans les bras
traités par FAM et par 5-FU seul, malgré un meilleur taux de
RO pour le FAM (38 % versus 18 %). Un troisième bras asso-
ciant 5-FU-adriamycine était testé dans cet essai avec les
mêmes mauvais résultats, d’autant plus que la toxicité dans les
bras polychimiothérapies était nettement supérieure au 5-FU
seul. Une autre étude plus récente (1994) retrouvait le même
type de résultats négatifs avec 3 autres schémas comparés au 5-
FU seul dont le protocole FAP (5-FU-adriamycine-cisplatine).
En revanche, une étude à 3 bras publiée en 1993 par Kim et coll.
(11) comparant au 5-FU les protocoles FAM et FP confirmait
l’absence d’efficacité du FAM mais notait une amélioration
significative de la survie sans progression et du taux de RO en
faveur du bras FP, sans traduction statistiquement significative
sur la survie globale.
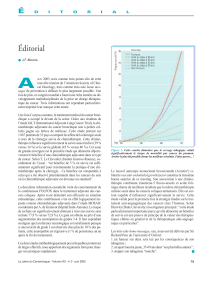
• Essais comparant des polychimiothérapies entre elles : L’ e ff i c a c i t é
du FAMTX a surtout été démontrée par une étude randomisée de
l ’ E O RTC le comparant au FAM avec une toxicité moindre, un
meilleur taux de RO (41 % versus 9 %) et une médiane de survie
plus longue de 14 semaines en faveur du FAMTX ( 1 2 ) .
Un autre essai de phase III a ensuite comparé le protocole EAP
au FAMTX ( 1 3 ). Cet essai qui devait inclure 130 patients a été
interrompu prématurément après inclusion des 60 premiers
patients en raison de la survenue d’une toxicité significativement
supérieure dans le bras EAP entraînant 4 décès toxiques. A u
moment de l’arrêt des inclusions, le taux de RO était de 33 %
dans le bras FAMTX versus 20 % dans le bras EAP. Les auteurs
concluaient que le FAMTX était au moins aussi actif que l’EAP
et avait une toxicité moins sévère et plus facile à gérer.
La valeur relative des protocoles FP, FAMTX et ELF a été com-
parée dans une étude de l’EORTC ayant inclus plus de
340 patients qui n’a pas retrouvé de différence ni en termes de
réponse, ni en termes de survie entre ces trois protocoles.
Enfin, une étude de phase III comparant le protocole ECF au
protocole FAMTX a été publiée en 1997 (14) : les résultats sont
à l’avantage du protocole ECF aussi bien en termes de taux de
RO (45 % vs 21 %) que de médiane de survie (8,9 mois vs 5,7
mois). La toxicité était surtout hématologique et infectieuse
pour le FAMTX et essentiellement digestive avec l’ECF.
Au vu de ces études de phase III successives, certains considè-
rent actuellement le schéma ECF comme le protocole “stan-
dard” dans les adénocarcinomes gastriques. Il impose cependant
au patient une perfusion continue sur plusieurs semaines et
aucune comparaison valable sur la qualité de vie n’a encore été
donnée avec ces derniers protocoles. De plus, même si l’on
semble avoir passé un certain cap en termes d’efficacité antitu-
morale définie par le taux de RO avec les polychimiothérapies
les plus récentes, notamment le protocole ECF, les médianes de
survie de toutes ces études de phase III sont encore
désespérément faibles, comprises au mieux entre 7
et 9 mois. Il faut donc se poser encore la question
de la place d’une chimiothérapie peu toxique à base
de 5-FU-AF par rapport à des protocoles plus
contraignants à base de 5-FU continu et de cisplati-
ne. Enfin, il reste à découvrir d’autres schémas uti-
lisant de nouvelles drogues et permettant des alter-
natives efficaces en deuxième ligne de chimiothéra-
pie pour espérer allonger un peu la survie encore
catastrophique de ces patients.
LE TRAITEMENT DES FORMES LOCALE-
MENT AVANCÉES
La chimiothérapie préopératoire
Elle est apparue il y a une dizaine d’années pour des
patients ayant des tumeurs non résécables en raison
de l’extension locale. Wilke et coll. (15) ont montré
la faisabilité dans cette indication de l’EAP à partir
Poly-
chimiothérapies
FAM
FAMTX
12
(1991) 105
107
9
p = 0,0001
41
29 semaines
p = 0,004
42 semaines
FAMTX
EAP
13
(1992) 30
30
33
ns
20
Décès toxiques :
0
4
FAMTX
EAP
14
(1997)
130
126
21
p = 0,0002
45
5,7 mois
p = 0,0009
8,9 mois
Réf.
(année) Nombre
patients
Pourcentage
de RO
Survie
médiane
Tableau I. Polychimiothérapie des adénocarcinomes gastriques. Essais de phase III publiés
comparant des polychimiothérapies entre elles.

La Lettre de L’Hépato-Gastroentérologue - n° 1 - février 199830
D
O S S I E R T H É M A T I Q U E
d’une série de 34 patients présentant initialement une tumeur
gastrique considérée comme inextirpable lors d’une laparoto-
mie initiale ; la chimiothérapie a entraîné 70 % de RO, et 15
gastrectomies macroscopiquement complètes ont pu être réali-
sées parmi les 23 patients répondeurs. Une autre étude a montré
qu’après chimiothérapie d’une tumeur inextirpable lors d’une
première laparotomie, 41 % des patients bénéficiaient d’une
résection curative secondaire. L’expérience de l’Institut
Gustave-Roussy est proche, avec un taux de résection macro-
scopiquement complète de 77 % parmi 30 patients ayant une
tumeur localement avancée et traités par 3 cures de FP en pré-
opératoire. Il s’agissait cependant de tumeurs jugées a priori
résécables dans la majorité des cas, et ayant donc bénéficié là
d’une chimiothérapie dite néoadjuvante ou d’induction.
Ainsi, la chimiothérapie préopératoire peut présenter un intérêt
lorsque la tumeur est a priori inextirpable car elle permet parfois
une résection secondairement complète avec des survies qui
peuvent être prolongées. Sa place mérite aussi d’être discutée
quand une chirurgie paraît possible mais en cas de tumeur de
mauvais pronostic, par exemple de stade T3-T4 à l’échoendo-
scopie ou avec de volumineuses adénopathies, mais les essais
de phase III en cours dans cette situation devront répondre à
cette question.
La radiothérapie et la radiochimiothérapie
L’association de chimiothérapie et de radiothérapie a été utilisée
essentiellement en cas de tumeur inextirpable ou de résection
incomplète. Dans l’étude randomisée de la Mayo Clinic compa-
rant la radiothérapie seule à l’association 5-FU-radiothérapie
pour des cancers gastriques inextirpables, la survie moyenne
des malades traités par l’association était significativement
supérieure (16). Ultérieurement, une étude du GITSG n’a pas
démontré de gain de survie à moyen terme en faveur de l’asso-
ciation méthyl-CCNU, radiothérapie par rapport à la radiothéra-
pie seule, en raison d’une toxicité importante dans le groupe
recevant la chimiothérapie. Cependant, à long terme, il n’y avait
de survivant que dans le groupe traité par l’association (17). En
situation néoadjuvante, une radiothérapie associée à un proto-
cole FP concomitant pourrait augmenter la survie des adénocar-
cinomes du cardia selon une étude récente de phase III qui méri-
te cependant d’être confirmée, et ces résultats ne peuvent pas
être élargis aux localisations gastriques sous-cardiales pour les-
quelles l’irradiation pose plus de problèmes.
CONCLUSION
◗La chimiothérapie permet une amélioration modérée de la
survie et de la qualité de vie par rapport à un simple traitement
symptomatique dans les cancers gastriques métastatiques.
◗Il n’y a pas actuellement de protocole de chimiothérapie
consensuel, mais on sait qu’il vaut mieux utiliser soit des sché-
mas basés sur la combinaison de 5-FU et de cisplatine, soit sur
l’association 5-FU-acide folinique.
◗Les nouvelles molécules disponibles dans d’autres localisa-
tions méritent certainement d’être évaluées dans cette situation.
◗En cas de formes localement avancées non résécables mais
non métastatiques chez des patients opérables, il faut tenter une
chimiothérapie efficace (FP ou ECF) qui peut permettre secon-
dairement une résection macroscopiquement complète.
◗La radiothérapie n’a qu’une place marginale dans les formes
avancées de cancers gastriques, en dehors des localisations par-
ticulières au cardia dont le traitement s’apparente plus alors à
celui des cancers de l’œsophage.
◗Le pronostic de ces cancers gastriques avancés reste encore
très mauvais, avec une médiane de survie globale qui n’atteint
pas 1 an, d’où la nécessité de traiter le plus possible de patients
dans le cadre d’essais thérapeutiques prospectifs. ■
R
É F É R E N C E S B I B L I O G R A P H I Q U E S
1. Rougier P., Olivera J. et coll. Efficacité des chimiothérapies et des associations
chimio-radiothérapiques dans les adénocarcinomes gastriques. Bull Cancer
1989 ; 76 : 1007-20.
2. MacDonald J.S., Schein P.S. et coll. 5-fluorouracil, doxorubicin, mitomycin C
and adriamycin (FAM) : a new combination chemotherapy program for advanced
gastric carcinoma. Ann Intern Med 1980 ; 93 : 533-6.
3. Preusser P., Wilke H. et coll. Phase II study with the combination etoposide,
doxorubicin, and cisplatin in advanced measurable gastric cancer. J Clin Oncol
1989 ; 7 : 1310-7.
4. Lacave A.J., Baron F.J. et coll. Combination chemotherapy with cisplatin and
5-fluorouracil 5-day infusion in the therapy of advanced gastric cancer : a phase
II trial. Ann Oncol 1991 ; 2 : 751-4.
5. Rougier P., Ducreux M. et coll. Efficacy of combined 5-fluorouracil and cis -
platinum in advanced gastric carcinomas : a phase II trial with prognostic factor
analysis. Eur J Cancer 1994 ; 304 : 1263-126
6. Ohtsu A., Shimada Y. et coll. Phase II study of protacted infusional 5-fluorou -
racil combined with cisplatinum for advanced gastric cancer : report from the
Japan Clinical Oncology Group (JCOG). Eur J Cancer 1994 ; 14 : 2091-3.
7. Findlay M., Cunningham D. et coll. Aphase II study in advanced gastrooeso -
phageal cancer using epirubicin and cisplatin in combination with continuous
infusion 5-fluorouracil (ECF). Ann Oncol 1994 ; 5 : 609-13.
8. Murad A., Santiago F. et coll. Modified therapy with 5-fluorouracil, doxorubi -
cin, and methotrexate in advanced gastric cancer. Cancer 1993 ; 72 : 37-41.
9 . P y r hönen S., Kuitunen T. et coll. Randomized comparison of fluorouracil, epi -
d o x o rubi cin and methotrexate (FEMTX) plus supportive care with support i v e
c a re alone in patients with non-resectable gastric cancer. Br J Cancer 1995 ;
7 1 : 587-91.
10. Glimelius B., Ekström K. et coll. Randomized comparison between chemothe -
rapy plus best supportive care with best supportive care in advanced gastric can -
cer. Annals of Oncology 1997 ; 8 : 163-8.
11. Kim N.K., Park Y.S. et coll. A Phase III randomized study of 5-fluorouracil and
cisplatin versus 5-fluorouracil, doxorubicin, and mitomycin versus 5-fluoro u r a c i l
alone in the treatment of advanced gastric carcinoma. Cancer 1993 ; 71 : 3813-8.
12.
Wils J., Klein H. et coll. Sequential high-dose methotrexate and fluoro u -
racil combined with doxoru b i c i n : a step ahead in the treatment of advanced
gastric cancer. A trial of the European Organization for Research and
Treatment of Cancer Gastrointestinal Tract Cooperative Group. J Clin Oncol
1 9 9 1 ; 9 : 827-31.
13. Kelsen D., Atiq O.T. et coll. FAMTX versus etoposide, doxorubicin, and cispla -
t i n : a random assignment trial in gastric cancer. J Clin Oncol 1992 ; 10 : 541-8.

La Lettre de L’Hépato-Gastroentérologue - n° 1 - février 1998 31
Anti-H2 et cancer de l’estomac :
effet immunomodulateur,
effet anti-prolifératif ou absence d’effet ?
Les cancers gastro-intestinaux induisent une immunodépression surtout en cas de maladie avancée, majorée par les traitements
chirurgicaux. Les effets immunomodulateurs et anti-prolifératifs des anti-H2 sont connus de longue date,ce qui leur confère un
intérêt au moins théorique dans le cancer de l’estomac.
En 1990, une étude danoise (1) mettait en évidence une augmentation (juste) significative de la survie chez les patients présen-
tant un cancer de l’estomac et recevant de la cimétidine à raison de 400 mg 2 fois par jour pendant 2 ans. Il s’agissait d’une étude
prospective randomisée contre placebo,conduite en double aveugle et stratifiée selon le type d’intervention chirurgicale réalisée.
Cent quatre-vingt-un patients furent inclus (157 finalement analysés). La médiane de survie était de 450 j dans le groupe ciméti-
dine et 316 j dans le groupe contrôle (p = 0,02).
Wotherspoon et coll. (2) ont conduit une étude similaire en randomisant 159 patients opérés pour cancer gastrique,pour rece-
voir de la ranitidine ou du placebo.Le traitement était débuté en IV dès l’induction de l’anesthésie et poursuivi per os à la repri-
se de l’alimentation entérale et pour un minimum de 2 ans. Les résultats de l’étude danoise ne furent pas reproduits, puisque,
malgré un suivi identique (entre 2 et 4,8 ans), aucune différence de survie n’était retrouvée entre les deux groupes : survie média-
ne de 280 j et 344 j respectivement dans le groupe ranitidine et dans le groupe placebo.
La discordance apparente des résultats de ces deux études randomisées et conduites selon un protocole identique peut éven-
tuellement être expliquée par les travaux in vitro de Hahm et coll. (3, 4).On admet que l’action immunomodulatrice des anti-H2
associe une inhibition de l’activité des lymphocytes T suppresseurs et une augmentation de la production d’interleukine-2 et de
l’activité des cellules natural killer. Cependant, en comparant l’action immunomodulatrice de la cimétidine,de la ranitidine et de
la famotidine,les auteurs ont montré que la cimétidine avait l’effet immunomodulateur le plus marqué et la famotidine le plus
faible. Seule la cimétidine augmentait la réponse cytotoxique et proliférative des lymphocytes au mitogène (3).Les mêmes auteurs
ont également comparé l’effet anti-prolifératif de ces trois molécules :là encore, seule la cimétidine inversait la prolifération cel-
lulaire induite par l’histamine de façon significative. La ranitidine avait aussi tendance à atténuer cette prolifération dose-dépen-
dante mais sans atteindre le seuil de significativité et la famotidine n’avait aucun effet (4).En fait,Tonnesen et coll. ont appliqué la
même méthodologie que celle utilisée par l’équipe anglaise 9 ans auparavant, mais n’ont pas testé la même molécule !
Au total, on ne sait toujours pas si les anti-H2 ont un effet autre que théorique chez les patients atteints de cancer gastrique,
mais on sait qu’ils n’ont pas tous le même effet !
L. Choné
1.
Tonnesen H., Knigge U.et coll. Effect of cimetidine on survival after gastric cancer.Lancet 1988 ; ii : 990-2.
2.
Wo t h e r spoon H.A.,A n d e rson J.R. et coll. R a n d o m i z ed controlled trial of an H2-receptor antagonist in gastric cancer. Br J Surg 1997 ; 8 4 :1 1 6 8 - 9 .
3.
Hahm K.B., Kim W.H. et coll. Comparison of immunomodulative effects of the histamine-2 receptor antgonists cimetidine, ranitidine and famotidine
on peripheral blood mononuclear cells in gastric cancer patients.Scand J Gastroenterol 1995 ;30 : 265-71.
4.
Hahm K.B., Park I.S.et coll. Comparison of antiproliferative effects of 1-histamine-2 receptor antagonists, cimetidine, ranitidine and famotidine in
gastric cancer cells.Int J Immunopharmacol 1996 ; 18 : 393-9.
14. Webb A., Cunningham D. et coll. Randomized trial comparing epirubicin, cis -
platin and fluorouracil versus fluorouracil, doxorubicin and methotrexate in
advanced esophagogastric cancer. J Clin Oncol 1997 ; 15 : 261-7.
15. Wilke H., Preusser P. et coll. Preoperative chemotherapy in locally advanced
and non resectable gastric cancer : a phase II study with etoposide, doxorubicin,
and cisplatin. Cancer 1989 ; 7 : 1318-26.
16. Moertel C.G., Childs D.S. et coll. Combined 5-fluorouracil and radiation the -
rapy as a surgical adjuvant for poor prognosis gastric carcinoma. Lancet 1969 ;
ii : 865-7.
17. Gastro Intestinal Tumor Study Group. Acomparative clinical assessment of
combination chemotherapy in the management of advanced gastric carcinoma.
Cancer 1982 ; 49 : 1362-6.
1
/
5
100%